Publié le 06 fév 2018Lecture 8 min
Embolie pulmonaire aiguë - Place de l’angioscanner thoracique
Émilie REYMOND, Hôpital Nord, La tronche
Les signes cliniques de l’embolie pulmonaire ne sont ni sensibles ni spécifiques (dyspnée, douleur thoracique, syncope, hémoptysie, état de choc, etc.). Malgré cela, l’anamnèse et l’examen clinique demeurent primordiaux. Intégrés dans des scores, ils permettent d’établir la probabilité pré-test d’embolie pulmonaire (EP), afin de guider la prise en charge diagnostique.
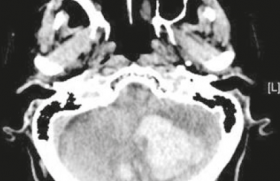
Patiente de 60 ans, découverte d’une embolie pulmonaire aiguë dans un contexte de malaise. Thrombi au sein des artères pulmonaires proximales.
Les scores de Wells et de Genève révisés, prenant en compte les signes cliniques mais aussi le contexte ont été simplifiés afin d’être largement utilisés en routine (tableaux 1 et 2)(1-3).
Ces scores classent les patients en 2 (EP peu probable ou EP probable) ou 3 catégories (probabilité faible, intermédiaire ou élevée). En utilisant ces critères, il est attendu un taux de patients avec une EP confirmée de 10 % dans la catégorie avec une faible probabilité, 30 % dans la catégorie avec une probabilité intermédiaire et 65 % dans la catégorie élevée(4).
Le scanner thoracique spiralé avec injection de produit de contraste, du fait de ses performances diagnostiques, de sa rapidité d’exécution et de son accessibilité est l’examen de référence pour le diagnostic d’embolie pulmonaire(5).
Les innovations techniques permettent de réaliser des coupes millimétriques, d’obtenir une opacification correcte des artères pulmonaires en injectant une faible quantité de produit de contraste iodé (50 ml) en un temps d’acquisition court (moins de 10 secondes) pour une apnée de qualité.
Un angioscanner thoracique de bonne qualité permet d’analyser les artères pulmonaires au moins jusqu’au niveau sous-segmentaire et de visualiser 94 % des artères de 5e ordre(6).
L’intérêt du scanner est également de poser, dans un certain nombre de cas, un diagnostic différentiel (pneumopathie, œdème pulmonaire aigu, etc.)
Malgré sa facilité d’accès, c’est un examen irradiant, et il reste toujours indispensable de stratifier les malades selon leur probabilité prétest afin de réduire le nombre d’examens inutiles et de préserver la pertinence des résultats(5).
L’European Society of Cardiology a, en 2014, reprécisé la stratégie diagnostique(1). Il existe deux situations cliniques bien distinctes :
• dans un contexte de choc, si une embolie pulmonaire est suspectée, le scanner thoracique injecté est indiqué en première intention s’il est immédiatement disponible. Dans le cas contraire, il faut réaliser une échographie cardiaque à la recherche de signes de cœur pulmonaire aigu. Si la dysfonction ventriculaire droite est confirmée, le scanner sera réalisé dans un second temps (algorithme 1).
• en dehors de l’état de choc, le scanner est l’examen de première intention en cas de probabilité clinique forte. Lors de probabilité clinique faible ou intermédiaire, celui-ci sera demandé en cas de valeur normale des D-dimères (algorithme 2).
Algorithme 1. Stratégie diagnostique de l’embolie pulmonaire dans un contexte de choc.
Algorithme 2. Stratégie diagnostique de l’embolie pulmonaire en dehors d’un contexte de choc.
L’interprétation des résultats du scanner est toujours fonction de la probabilité clinique(7) :
– pour les patients avec une probabilité clinique faible ou intermédiaire, un scanner négatif à une valeur prédictive négative (VPN) élevée (89 à 96 %) ;
– alors que chez les patients avec une probabilité clinique forte, la VPN est seulement de 60 %.
À l ’ inverse, un angioscanner positif a une valeur prédictive positive (VPP) élevée (92 à 96 %) pour les patients avec une probabilité élevée ou intermédiaire, alors que lorsque la probabilité prétest est faible, la VPP n’est que de 58 %.
Il est donc admis qu’un angioscanner thoracique négatif soit suffisant pour exclure le diagnostic d’embolie pulmonaire chez les patients avec une probabilité clinique non élevée.
Chez les patients avec une probabilité prétest élevée et un angioscanner négatif, il reste discuté de savoir si ces patients doivent avoir d’autres explorations avant de décider une abstention thérapeutique.
Cas particuliers
La femme enceinte
Le diagnostic est délicat dans ce contexte ; le risque thrombotique est accru par l’état d’hypercoagulabilité et les signes cliniques restent peu spécifiques. La problématique supplémentaire est de limiter au maximum l’irradiation de la mère (la glande mammaire et le parenchyme pulmonaire étant des organes particulièrement radiosensibles), et celle du fœtus.
Il n’existe pas de score de probabilité clinique prétest adapté aux femmes enceintes.
L’American Thoracic Society et la Society of Thoracic Radiology ont proposé une prise en charge diagnostique en 2011(7).
Il est recommandé de ne pas doser les D-dimères chez la femme enceinte, des cas de faux négatifs ayant été rapportés.
Si la patiente présente des signes cliniques associés de thrombose veineuse profonde, il est recommandé de réaliser une échographie Doppler des membres inférieurs en première intention, dont le résultat positif suffira à débuter un traitement anticoagulant.
En cas d’absence de signe clinique de thrombose veineuse profonde, la radiographie thoracique est recommandée en première intention car la dose de radiation délivrée est minimale, et qu’elle permet d’orienter la suite de la prise en charge diagnostique.
Si la radiographie est normale, la scintigraphie de ventilation-perfusion est recommandée plutôt que l’angioscanner, puisqu’elle permet de limiter l’irradiation maternelle et délivre une dose acceptable au fœtus.
L’angioscanner thoracique est proposé :
– si la radiographie thoracique est anormale puisqu’en cas d’anomalie du parenchyme pulmonaire, la scintigraphie de ventilation-perfusion ne sera pas contributive ;
– en seconde intention si la scintigraphie de ventilation perfusion est non diagnostique.
Insuffisance rénale ou allergie au produit de contraste iodé
En cas de clairance de la créatinine < 30 ml/min ou d’antécédent de réaction allergique grave au produit de contraste iodé, l’injection est contre-indiquée. La scintigraphie de ventilation- perfusion est alors proposée en première intention. Le scanner sans injection peut être proposé pour les diagnostics différentiels.
Séméiologie scannographique de l’EP aiguë
Les signes directs sont les seuls permettant d’affirmer le diagnostic : ils correspondent à la présence d’un thrombus au sein d’une artère pulmonaire(8). Deux types d’images sont possibles (figure 1) :
– une occlusion partielle d’une artère pulmonaire se traduisant par une lacune centrale ou marginalisée, cernée par du produit de contraste correspondant au sang circulant opacifié ;
– une occlusion complète, avec une lacune hypodense occupant toute la lumière de l’artère, dont le calibre est souvent augmenté du fait de la présence de l’embole.
Figure 1. Patiente de 60 ans, découverte d’une embolie pulmonaire aiguë dans un contexte de malaise. A : thrombi au sein des artères pulmonaires proximales. B et C : l’artère lobaire moyenne est complétement occluse par le thrombus, élargie et avec un défaut complet de rehaussement. Les artères lobaire inférieure droite et segmentaire de la pyramide basale gauche sont partiellement thrombosées, avec une lacune centrale entourée par du produit de contraste. D : signes de cœur pulmonaire aigu avec dilatation du ventricule droit, inversion du rapport VD/VG.
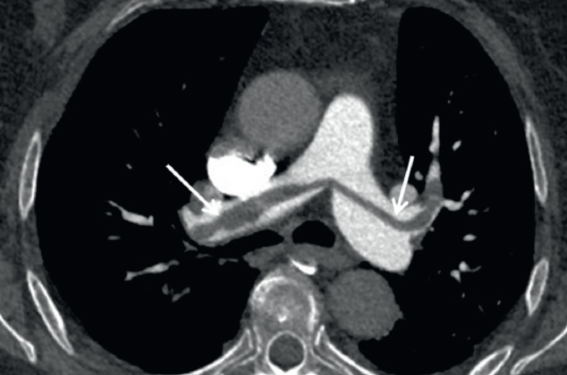
Les signes indirects sont (figure 2) :
– un infarctus parenchymateux (condensation pulmonaire triangulaire à base sous-pleurale, ou un aspect de « cadre grillagé » avec une zone centrale dépolie cernée par une condensation parenchymateuse) ;
– un épanchement pleural réactionnel ;
– des atélectasies planes.
Figure 2. Patient de 50 ans adressé pour scanner de contrôle d’un adénocarcinome colique. A : sur le scanner injecté au temps veineux, découverte d’un épanchement pleural gauche de faible abondance (flèches). Pas de thrombus visible au sein des artères pulmonaires mais le temps d’injection veineux n’est pas adapté à cette étude. B (axiale) et C (sagittale) : l’analyse du parenchyme pulmonaire retrouve un aspect typique d’infarctus pulmonaire de la lingula (flèches) avec une condensation périphérique et une plage en dépoli centrale. Ce signe indirect fait fortement suspecter une embolie pulmonaire. D : le patient bénéficie donc d’une nouvelle injection avec un temps d’acquisition adapté pour l’analyse des artères pulmonaires. Ceci permet de confirmer le diagnostic d’embolie pulmonaire en mettant en évidence un thrombus segmentaire au niveau de la lingula.
Intérêt du scanner dans l’évaluation pronostique à court terme
Deux approches sont discutées pour évaluer la sévérité de l’embolie pulmonaire : quantifier la charge embolique ou évaluer le retentissement cardiaque droit. De nombreuses études se sont concentrées sur l’évaluation de la charge embolique mais la corrélation entre le degré d’obstruction artérielle et la mortalité précoce reste controversée. Il semble que ce soit plutôt la réserve pulmonaire du patient qui soit importante : une charge embolique même faible chez un patient précaire peut entraîner une décompensation sévère alors qu’elle sera asymptomatique chez un patient avec une fonction pulmonaire préservée(9). Le scanner permet d’apporter des informations sur la fonction ventriculaire droite, celle-ci étant le facteur pronostique majeur chez les patients hémodynamiquement stables(9).
Il existe plusieurs signes scannographiques de dysfonction ventriculaire droite (dilatation des cavités cardiaques droites, inversion du rapport VD/VG devenant > 1, septum paradoxal, reflux de produit de contraste). Il apparaît que le rapport VD/VG est le paramètre le mieux corrélé à la morbidité et mortalité intrahospitalière(10).
L’inversion du rapport VD/VG est le seul facteur prédictif de mortalité à 3 mois chez les patients initialement hémodynamiquement stables et ayant une faible charge embolique(11).
Cette évaluation est simple et rapide : il n’est pas nécessaire de réaliser des reformations « 4 cavités », la mesure des diamètres transverses ventriculaires à mi-hauteur des cavités sur des coupes axiales étant suffisante(12) (figure 1). Il est même actuellement admis qu’une évaluation subjective de la dilatation du ventricule droit est pertinente : le fait que le ventricule droit apparaisse plus large que le gauche a la même valeur pronostique que des calculs de rapport plus précis(13).
Intérêt des évolutions récentes en scanner pour la détection de l’EP
Le scanner synchronisé à l’ECG
L’acquisition couplée à l’ECG permet de s’affranchir des mouvements cardiaques, réduisant les artefacts de battement notamment au niveau de la lingula et du lobe inférieur gauche(6), mais avec un examen plus long et une irradiation plus importante, ne justifiant pas son utilisation dans cette indication.
L’autre intérêt de la synchronisation est d’évaluer dans le même temps les artères coronaires(5) ce qui semble intéressant dans un contexte de douleur thoracique aiguë. Là encore, l’irradiation supplémentaire ne permet pas de justifier cette technique pour toute suspicion d’embolie pulmonaire(14)
La synchronisation cardiaque permet d’évaluer de manière précise la fonction ventriculaire droite mais cette précision n’est pas supérieure à l’évaluation plus simple sur des coupes non synchronisées(10).
Détection automatique des emboles par ordinateur
Le CAD (computer assisted detection) permet la détection automatique des emboles. Ceci permet d’augmenter la sensibilité de détection de l’embolie pulmonaire, sans perte de spécificité(15). Il n’est pour l’instant utilisé qu’en complément d’une lecture « classique » du scanner.
Scanner double énergie
Le scanner double énergie consiste en une acquisition simultanée des images à des kilovoltages différents(16). Cette technique apporte à la fois des informations morphologiques et fonctionnelles : elle permet l’étude habituelle des artères pulmonaires mais aussi une évaluation de la perfusion du parenchyme pulmonaire dans le même temps d’acquisition, avec une même injection de produit de contraste et sans irradiation supplémentaire. Toutefois, comme en scintigraphie, l’analyse de la perfusion peut donner des faux positifs en cas de parenchyme pulmonaire anormal.
Références sur simple demande à la rédaction : biblio@len-medical.fr
"Publié dans OPA Pratique"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :