Focus-Nouvelle technique
Publié le 31 déc 2007Lecture 7 min
Imagerie en cohérence optique intracoronaire
M. ANGIOI, Hôpital de Brabois, CHU de Nancy
L’imagerie en cohérence optique (OCT) est un système d’imagerie diagnostique haute résolution en temps réel qui utilise un rayonnement lumineux proche de l’infrarouge. Elle est déjà utilisée en routine dans d’autres spécialités, en particulier pour l’imagerie de la rétine en ophtalmologie. L’utilisation endovasculaire a été développée au Japon dès le début des années 90. Cette technique très prometteuse est pour le moment utilisée dans des indications de recherche tout comme l’échographie endocoronaire à ses débuts. La simplification de la technique d’acquisition des images va rendre possible à cours terme l’émergence d’applications cliniques.
Principe de l’OCT et technique d’acquisition des images
Le principe est similaire à celui du Doppler ; la diffusion d’un rayonnement lumineux vers un tissu et le recueil du signal rétro-diffusé permet d’en déduire ses caractéristiques et ainsi d’obtenir une image. La différence avec le Doppler est lié à la vitesse de propagation de la lumière (plus rapide) qui oblige à utiliser un système d’interférométrie (avec un deuxième faisceau lumineux dit de « référence » qui n’est pas dirigé sur les tissus à analyser) pour mesurer le rayonnement rétro-diffusé.
La difficulté pour l’imagerie intravasculaire est que l’hémoglobine empêche la propagation du rayonnement lumineux. Il n’est donc possible d’obtenir une image de la paroi que si le vaisseau est « vide » de sang ce qui nécessite, pour les acquisitions, l’utilisation d’un système d’occlusion artérielle comme pour l’angioscopie. En fait, ce problème est en voie de résolution puisque lors d’une injection d’iode, il y a un phénomène de dispersion du sang qui est suffisant pour autoriser l’acquisition des images. Néanmoins, la quantité d’iode à injecter pour obtenir des images de qualité (encore en cours d’évaluation mais vraisemblablement 2 à 3 ml/s) peut également être un facteur limitant.
Actuellement, le seul système d’OCT intravasculaire est celui de la société LightLab Imaging. Le système est constitué d’une console M2, d’un système de retrait motorisé, d’une fibre optique dans un cathéter (ImageWire™) et d’un ballon d’occlusion coaxial basse pression (pression d’éclatement à 1 atm) avec deux marqueurs (Helios™ OBC) et inflateur adapté. Le système est compatible 6F avec le ballon qui a un profil déflaté de 4,3 F et un corps de 4,4 F.
L’ImageWire™ est constitué d’un cathéter de 1,4 F (0,019’’) avec une extrémité distale floppy radio opaque de 15 mm. À l’intérieur de cette gaine la fibre optique se déplace grâce au système de retrait, elle fait elle-même 0,006’’ avec un point lumineux de 2 à 3 microns.
Le principe d’utilisation classique est de franchir la zone à imager avec un guide long de dilatation, de passer le ballon coaxial en aval de cette zone, de retirer le guide, et de passer l’ImageWire™ dans le ballon. Celui-ci est alors retiré en amont de la zone à imager puis inflaté à basse pression ce qui permet de flusher la coronaire avec du produit salé isotonique. Dès que l’image du vaisseaux apparaît, on peut déclencher le retrait motorisé (1 ou 2 mm/s). Une fois celui-ci terminé, on déflate, on retire l’ImageWire™ et, s’il s’agissait de l’évaluation d’une lésion avant angioplastie, on peut remettre un guide en place.
Ce protocole d’utilisation requiert un certain entraînement pour limiter au maximun le temps d’occlusion. Cependant, il ne permet pas d’imager les segment proximaux (impossibilité d’occlusion). La présence d’une grosse collatérale juste en aval du flush peut également dégrader sa qualité et donc celle des images.
Une technique développée récemment consiste à réaliser l’acquisition pendant un flush d’iode sans occlusion. Il s’agit certainement d’une technique prometteuse mais qui demande à être mieux standardisée, avec en particulier, la détermination de la quantité et de la vitesse d’injection minimale d’iode pour obtenir des images de qualité suffisante. La longueur du retrait est limitée par la quantité d’iode que l’on peut injecter, mais cette technique autorise l’imagerie des segments proximaux. Enfin, dans ce cas l’ImageWire™ doit être utilisé seul pour franchir la zone d’intérêt ce qui peut être assez difficile actuellement puisqu’il ne s’agit pas d’un guide de franchissement.
Résultats et applications
Le principal avantage de cette technique par rapport à l’échographie est sa résolution mais avec une profondeur d’examen moindre.
Un comparatif des deux techniques est résumé dans le tableau.
Tout comme l’échographie, l’imagerie par OCT n’est pas dénuée d’artefacts qui doivent être bien connus pour interpréter les images. Toutes les mesures de longueur et de surface sont accessibles en direct sur la console avec zoom pour des mesures de précision sur des zones d’intérêt précises (comme au-dessus d’une maille de stent).
La sémiologie de l’exploration intravasculaire en OCT a été déduite de la comparaison des images avec des examens anatomopathologiques.
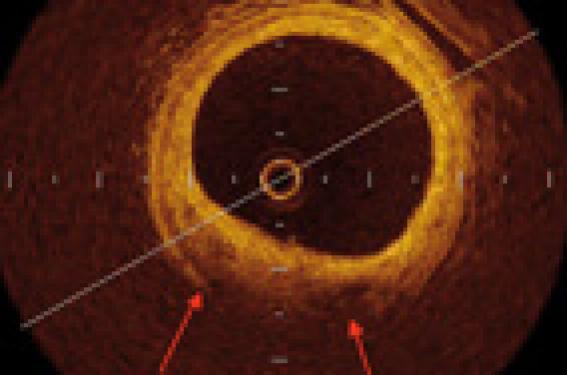
La résolution de l’OCT permet de différencier la structure en trois couches de l’artère normale (figure 1) : intima-média-adventice (succession hyper-hypo-hyper signal et leurs limitantes en hypersignal).
La présence de plaques d’athérome (figure 2) est caractérisée par une perte de l’organisation en trois couches avec des caractéristiques variables selon leur composition. Schématiquement, les plaques fibreuses sont homogènes avec un hypersignal, les contenus lipidiques sont moins homogènes avec un faible signal et sont mal délimités. Les calcifications peuvent prendre des aspects différents hétérogènes (plutôt hyposignal, mais parfois hypersignal voire les 2 aspects dans la même plaque), avec des limites franches et l’équivalent d’un cône d’ombre postérieur.
Figure 1. Aspect artériel « 3 feuillets » en OCT (à gauche) qui n’est pas visible en écho-endocoronaire (à droite) ou seule l’intima-média est différentiable. Coupe histologique correspondante avec coloration Masson-trichrome (reproduit avec la permission de Light Lab Imaging France).
Figure 2. Plaque d’athérome mixte avec zones d’hyposignal mal limitées.
Si les plaques fibreuses et calcifiées sont généralement bien identifiées en écho-endocoronaire, l’OCT est supérieure pour l’identification des plaques à contenu lipidique ainsi que des zones d’hyperplasie intimale (hypersignal).
La résolution de la technique permet la mesure de l’épaisseur de la chape fibreuse de la plaque (zone en hypersignal séparant la plaque de la lumière) ce qui débouche sur l’identification potentielle des plaques à risque de rupture (c’est-à-dire celles qui ont l’épaisseur la plus faible). Cette mesure de l’épaisseur de la chape de la plaque a pu être couplée dans un travail fondamental à son analyse qualitative, la détermination de son degré d’infiltration macrophagique et donc son potentiel inflammatoire. Ces études de vulnérabilité de plaque restent en-core du domaine de la recherche et ouvrent la voie à l’évaluation des thérapeutiques ciblant spécifiquement la stabilisation de plaque (augmentation de l’épaisseur de la chape et diminution du contenu en lipides).
Les microthrombi sont parfaitement visibles (figure 3) avec la possibilité de différencier les thrombi plaquettaires des thrombi rouges.
L’identification des zones de rupture (surtout sur des plaques non sténosantes) est également un des points forts de l’OCT par rapport à l’écho-intravasculaire.
En interventionnel, les applications de l’OCT qui pourraient être développées prochainement concernent l’étude de l’apposition des stents qui est plus précise qu’en écho, mais surtout l’évaluation de la cicatrisation artérielle après pose de stent (en particulier actif) et la recherche des facteurs associés aux thromboses de stents (figures 4 à 7). L’évaluation de la présence d’une néoprolifération intimale après pose de stent actif ainsi que sa quantification en OCT commencent d’ailleurs à faire l’objet de communications dans les principaux congrès et même de publications. Ces travaux restent néanmoins préliminaires, mais il semble que nous disposons de l’outil adapté (surtout si l’imagerie sans injection est standardisée) pour évaluer les délais de recouvrement des stents actifs et l’incidence de leur retard ou de leur absence de recouvrement.
Figure 3. Microthrombus visible au contact d’une maille d’un stent Taxus™, 1 semaine après une thrombose tardive (18 mois) traitée par angioplastie.
Figure 4. Stent Cypher™ 18 mois après implantation. Absence de néoprolifération recouvrant les mailles du stent (flèches) et aspect en « vaguelettes » (acqui-sition réalisée sans occlusion avec flush iodé).
Figure 5. Néoprolifération visible entre 3 et 6 heures, 1 semaine après pose d’un stent nu.
Figure 6. Néoprolifération visible 3 mois après pose d’un stent Taxus™ recouvrant l’ensemble des mailles du stent (examen réalisé en prévision d’une chirurgie carcinologique urgente nécessitant un arrêt précoce des antiagrégants plaquettaires).
Figure 7. Aspect de défaut partiel de recouvrement d’un stent Taxus™ 21 mois après l’implantation, bien visible entre 1 et 6 heures (examen réalisé 1 semaine après un infarctus sur thrombose de stent, traitée par thromboaspiration et angioplastie au ballon).
Conclusion
L’OCT intracoronaire est une modalité d’imagerie haute résolution en temps réel. Le principal facteur limitant son utilisation est la nécessité d’occlusion artérielle. Cette technique va certainement remplacer l’échographie endocoronaire pour l’étude de la vulnérabilité de plaque. L’analyse de la néoprolifération après pose de stent semble d’ores et déjà être un domaine de recherche clinique envisageable.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


