Testé pour vous
Publié le 30 nov 2009Lecture 8 min
J.-L. LEYMARIE, O. DARREMONT, P. REYNAUD, Clinique Saint-Augustin, Bordeaux
L’arrivée d’un nouveau stent actif est forcément un événement majeur qui suscite l’intérêt de la communauté cardiologique. Le nouveau stent pharmaco-actif proposé par la société Terumo, le Nobori™ au biolimus A9, présente des caractéristiques tout à fait intéressantes et confirmées par d’excellents résultats cliniques et angiographiques.
Problématique
Si l’utilisation des stents pharmaco-actifs a marqué un progrès indiscutable en termes de lutte contre la resténose, nous avons pu observer des cas de thromboses tardives, voire très tardives. Cela a tout naturellement posé la question de la responsabilité du couple polymère-molécule dans l’observation de cas de thrombose avec un important retard, voire une quasi absence d’endothélialisation. L’efficacité ne peut se faire au prix de la sécurité. Certains ont imaginé un stent pharmaco-actif sans polymère, avec tous les problèmes de stabilité et de cinétique de relargage de la molécule que cela pose ; d’autres, l’administration systémique de la molécule pharmaco- active couplée à l’implantation d’un stent nu. Pour tenter d’imaginer le stent pharmaco-actif idéal, il faut donc répondre à un cahier des charges très précis puisqu’il doit être facile à poser, protégeant l’accès aux branches collatérales, efficace en termes de resténose et sûr s’agissant du risque de thrombose.
Le stent pharmaco-actif Nobori™ justement, par certains choix technologiques, tente de répondre à l’ensemble de ces questions.
Caractéristiques techniques du stent Nobori™
La plateforme du stent Nobori™ (figure 1) est une structure tubulaire en acier 316 L avec un design de cellules permettant de garantir des qualités de délivérabilité sans compromettre les paramètres biomécaniques (force radiale, ratio métal/artère et accessibilité aux branches collatérales).
Le biolimus A9 appartient à la famille des « limus » : son site d’action est identique aux autres limus actuellement utilisés (sirolimus, everolimus, zotarolimus). Cette proximité structurale permet d’envisager une efficacité au moins équivalente aux autres stents actifs utilisant une drogue de la famille des limus. Il possède de plus une très forte affinité lipidique garante d’une diffusion et une captation optimales dans la paroi.
Figure 1. Composants du Nobori™.
Comme la majorité des autres stents actifs, le Nobori™ utilise un polymère pour le transport et le relargage de la molécule. La particularité la plus intéressante de ce stent est l’utilisation d’un polymère entièrement résorbable en 6 à 9 mois. Il est uniquement positionné sur la face « pariétale » de la prothèse permettant ainsi d’assurer un transfert optimal du biolimus au niveau de son site d’action sans avoir des taux sériques élevés. La concentration maximale de biolimus circulant est 52 fois inférieure à celle constatée avec du sirolimus (étude NOBORI PK). La conjonction de ces caractéristiques pharmacodynamiques et spatiales, associées à la résorption du polymère, laisse entrevoir une grande sécurité d’utilisation en termes de risque de thrombose. En effet, l’endothélialisation peut se faire d’autant plus rapidement et plus sûrement que la face intraluminale est libre de polymère, et donc de molécule.
Les résultats cliniques
Le programme scientifique, NOBORI 1 (phase 1 et 2) est une étude prospective randomisée (2 pour 1), de non infériorité entre le Nobori™ et le Taxus® sur le critère primaire du LL intrastent à 9 mois et comporte des critères secondaires de décès cardiaque, infarctus du myocarde, pontage en urgence et TVR à 30 jours, 4, 9 et 12 mois puis tous les ans pendant 5 ans. Vingt-neuf centres répartis en Europe, Australie et Corée, ont inclus 363 patients (tableau 1).
Ce qui est remarquable, c’est que sur un suivi de 3 ans et selon les définitions ARC (Academic Research Consortium) il n’y a eu aucune thrombose dans le groupe Nobori™ (n = 235) contre un taux de 4,8 % de thromboses, essentiellement aiguës et subaiguës, dans le groupe Taxus® (n = 125) (tableau 2). La sécurité d’utilisation semble donc bien au rendez- vous. Tout cela devra être surveillé de près lors de la publication des résultats à 5 ans.
Parallèlement à la phase 2 de l’étude NOBORI 1, une autre étude NOBORI CORE a débuté, visant à comparer cette fois le Nobori™ au Cypher®. C’est une étude prospective, multicentrique de non infériorité sur le critère principal de LL à 9 mois et un suivi clinique à 1 an. L’essai a inclus 107 patients (Nobori™ biolimus A9 : 54 patients ; Cypher® sirolimus : 53 patients). Les caractéristiques cliniques et angiographiques sont équivalentes en dehors d’une proportion de diabétiques plus grande dans le groupe Cypher® sirolimus (28,3 %) que dans le groupe biolimus A9 (18,5 %) (tableau 3).
Si les résultats de cette étude sont très encourageants, elle souffre néanmoins de son petit nombre de patients inclus et de l’absence de randomisation directe. Les résultats angiographiques démontrent cependant que le stent Nobori™ au biolimus A9 présente un effet anti-prolifératif comparable à celui du Cypher® au sirolimus. Le faible taux de MACE observé confirme l’hypothèse de départ d’un stent efficace et sûr.
Pour le confronter maintenant à la « vraie vie », le registre prospectif NOBORI 2 a inclus 3 000 patients dans 20 pays d’Europe, d’Asie, d’Afrique et en Nouvelle-Zélande. Les inclusions sont terminées. Les critères de jugement sont le TLR, la mort d’origine cardiaque et le taux d’infarctus du myocarde à 12 mois. Les résultats du suivi à 1 an doivent être présentés au PCR 2010.
De nombreuses études ont été récemment publiées pour tenter d’apprécier l’avantage potentiel de la présence d’un polymère résorbable sur le risque de survenue d’une thrombose tardive. L’étude ISAR-TEST-4 a montré chez 2 603 patients que l’efficacité clinique à 12 mois de stents avec polymère biodégradable et rapamycine était comparable à ces mêmes stents avec polymère non biodégradable et rapamycine ou everolimus. Ces résultats confirment donc ceux de plusieurs études récentes montrant une non-infériorité d’efficacité clinique lors de l’utilisation d’un polymère biorésorbable. Le risque de survenue d’une thrombose (définition ARC) montre une tendance favorable (non significative) dans le bras avec polymère biorésorbable mais un suivi de plus long terme est donc nécessaire. Il reste bien des situations cliniques à évaluer. Certaines seront bientôt disponibles au travers des analyses de sousgroupes telles que les bifurcations, les diabétiques, les femmes, les syndromes coronariens aigus… D’autres vont poursuivre les analyses comparatives avec les autres stents pharmaco-actifs (Cypher® et Xience®) ou encore s’intéresser encore d’un peu plus près à la sécurité d’utilisation dont on peut penser qu’il peut s’agir d’un point fort de ce type de prothèse. Tout cela demande donc confirmation.
Conclusion
Les résultats cliniques de cette génération de stents sont donc très prometteurs, principalement dans le but d’améliorer la sécurité d’utilisation afin de ne pas exposer nos patients aux risques d’une bithérapie antiplaquettaire trop prolongée. Ne perdons cependant pas de vue qu’une excellente apposition initiale reste le meilleur garant du bon résultat. Nous attendons avec impatience les résultats du registre de vraie vie NOBORI 2 (3 000 patients) à 1 an, résultats qui seront présentés au PCR 2010.
Enfin, va débuter de manière imminente le registre européen e-NOBORI qui prévoit d’inclure 8 000 patients avec un suivi clinique et qui devrait débuter en France en mars 2010 dans 60 centres avec une inclusion compétitive. Au total, ce seront plus de 20 000 patients qui seront inclus dans les divers programmes de recherche clinique, études randomisés et registres, ce qui devrait nous donner une idée précise de l’intérêt clinique réel des options technologiques choisies par la société TERUMO pour son stent pharmaco-actif NoboriTM au biolimus A9.
Cas clinique
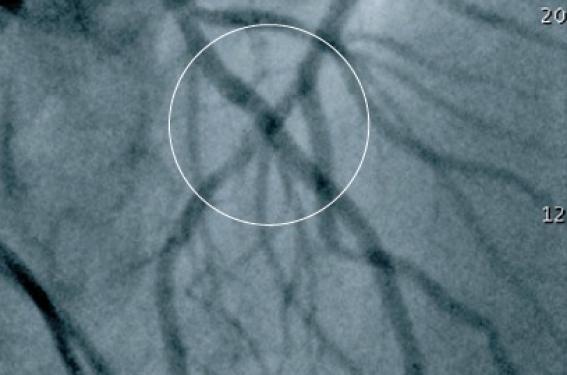
Mr P.L. âgé de 71 ans est hospitalisé pour un syndrome coronaire aigu (SCA) sans susdécalage de ST et sans mouvement de la troponine. C’est un patient hypertendu et dyslipidémique porteur d’une cardiopathie dilatée réputée primitive qui a bénéficié avec succès, en 2005, d’une resynchronisation puisque sa FE est passée de 30 % à 48 %. La coronarographie met en évidence une sténose très serrée et excentrée de la partie moyenne du 2e segment de l’IVA (figure 1). Après une préparation par une dose de charge de 600 mg de clopidogrel et l’augmentation d’une prise journalière d’aspirine de 75 à 160 mg, il bénéficie à la 48e heure d’une angioplastie de l’IVA par voie transradiale droite 6 F.
Figure 1. Lésion avant dilatation.
La procédure débute par l’administration par voie intraveineuse directe de 500 mg d’aspirine et de 0,01 ml/kg d’énoxaparine. Le tronc coronaire gauche est abordé grâce à un cathéter porteur EBU 4 ; la lésion est franchie sans difficulté par un guide BMW 0,014 et elle est dilatée par la pose d’un stent Nobori™ 3,0 x 18 mm largué à 12 atm pendant 20 secondes sans prédilatation mais impacté à haute pression (20 atm pendant 20 secondes) au moyen d’un ballon non compliant de 3,0 x 15 mm. Le résultat angiographique est satisfaisant (figure 2). Le traitement de sortie comprend la prescription de 75 mg de clopidogrel matin et soir pendant 1 mois ; la posologie est ensuite ramenée à une seule prise matinale pendant 12 mois (SCA). L’aspirine est maintenue à la posologie de 160 mg le soir. Au 8e mois, devant une hématurie macroscopique, il est mis en évidence une tumeur de vessie. On réalise alors un écho-Doppler cardiaque d’effort qui ne montre aucun signe de souffrance myocardique et un dosage du PFA-100 qui revient supérieur à 280 secondes ; le clopidogrel est donc stoppé progressivement sur 15 jours et Mr P.L. bénéficie d’une cystectomie totale sous monothérapie antiagrégante plaquettaire par aspirine sans complication ischémique et sans reprise du clopidogrel en postopératoire.
Figure 2. Résultat final.
Testé pour vous
Cette rubrique vise à vous informer sur les matériels les plus récents. L’industriel choisit l’expert qui teste le matériel et la rédaction de CATH’LAB n’intervient pas sur l’information délivrée. Il ne s’agit pour autant pas d’un publirédactionnel, l’auteur ayant toute liberté pour s’exprimer.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


