Publié le 25 sep 2007Lecture 9 min
Médecine vasculaire : quoi de neuf ?
C. MOUNIER-VEHIER, Ph. MARBOEUF, G. ROSEY et M. GRAS, CHRU de Lille
En pathologie vasculaire, le constat est saisissant : l’artériopathie oblitérante des membres inférieurs (AOMI) est sous-estimée car sa prévalence et son incidence ne sont pas connues avec précision, faute d’une bonne enquête statistique réalisée dans la population générale ; l’index de pression systolique (IPS) cheville/bras reste un examen peu connu et sous-utilisé. Enfin, l’ordonnance de l’artériopathe est souvent incomplète ou inappropriée.
L’IPS : sous-utilisée en médecine générale
Ainsi, l’étude française ATTEST (Atrial Therapy Efficacy and Safety Trial) souligne que l’IPS est mesuré chez moins d’un patient sur trois souffrant d’AOMI. N’avoir une valeur de l’IPS que chez un tiers des patients avec une AOMI isolée signifie que cette mesure reste sporadique en médecine générale, et que l’AOMI est méconnue par les médecins généralistes (MG). Pourtant, l’AOMI fait appartenir les patients à la catégorie à haut risque de mortalité cardiovasculaire (CV), comparable à celui des patients porteurs d’une coronaropathie.
Dans ATTEST, moins de 10 % des patients font le plein de la trithérapie, pourtant validée de l’AOMI : antiagrégant plaquettaire, statine et inhibiteur de l’enzyme de conversion (IEC)(1). Les nouvelles recommandations insistent sur le dépistage de l’AOMI chez le sujet à risque, sur l’importance d’une prise en charge globale avec l’instauration d’une trithérapie indépendamment des facteurs de risque CV(2).
Symptomatique ou non, l’AOMI doit être considérée comme un marqueur de risque CV, plaçant ces patients en situation de prévention secondaire(2,3).
IPS : l’examen le plus adapté pour dépister l’AOMI
L’examen clinique peut ne révéler aucune anomalie et ce sera la mesure des IPS qui conduira au diagnostic d’AOMI. Il s’agit de l’examen le plus adapté pour appréhender de façon simple et peu coûteuse l’état de perfusion distale des membres inférieurs, en permettant un dépistage précoce de l’AOMI, bien avant l’apparition de la claudication artérielle.
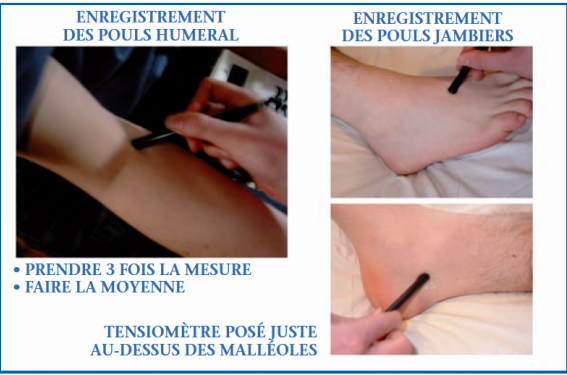
La mesure de l’IPS nécessite un appareil Doppler continu portatif et un appareil de mesure tensionnelle classique. L’IPS correspond au rapport entre la PAS à la cheville et la PAS humérale (figure 1). Le critère diagnostique retenu est un IPS < 0,90, qui témoigne d’un risque d’accident cardiovasculaire proche de celui du claudicant de même IPS (grade C) en même temps qu’il affirme l’AOMI. À l’inverse, un IPS > 1,30 est en faveur d’une incompressibilité des artères et constitue également un marqueur indépendant du risque CV(2,3).
Figure 1. Mesure de l’index de pression systolique à la cheville.
Cependant, même si la mesure de l’IPS peut être aujourd’hui considérée comme un excellent outil de dépistage, elle n’est guère applicable en dépistage de masse dans la population générale comme peut l’être la mesure brachiale de la pression artérielle, car très consommatrice de temps. En revanche, cette mesure est recommandée dans des populations présélectionnées à risque CV.
Le score PREVALENT
Dans ce sens, une équipe néerlandaise vient de publier un score clinique de prédiction d’avoir un IPS pathologique à partir d’une population de 7 454 patients âgés de plus de 55 ans suivis en médecine générale. Ces patients, inclus dans l’étude PREVALENT, devaient avoir au moins un facteur de risque CV (tabac, HTA, diabète, hypercholestérolémie) et être asymptomatiques à l’inclusion. L’AOMI était définie par un IPS < 0,9.
Sa prévalence dans cette étude (18,4 %) était comparable aux valeurs publiées. La construction du score clinique s’appuyait sur les facteurs de RCV classiques, à savoir l’âge, le sexe, le tabac, l’HTA, le diabète, l’hypercholestérolémie, des antécédents personnels d’accidents CV, une histoire familiale. Cette étude montre que le risque d’AOMI augmente principalement avec :
– l’âge (odds ratio [OR] : 1,34 par 5 ans ; IC 95%: 1,29-1,40) ;
– l’HTA non prise en charge (OR : 1,5 ; IC 95%: 1,3-1,8) ;
– l’HTA traitée (OR : 1,2 ; IC 95%: 1,1-1,4) ;
–les antécédents de tabagisme (OR : 1,4 ; IC 95%: 1,2-1,6) ;
– le tabagisme actif (OR : 2,9 ; IC 95% : 2,2-4,0).
Pour réaliser le score PREVALENT, les auteurs ont converti les OR en points : un OR de 1 correspondait à l’absence de FRCV, ensuite, un point était attribué à chaque augmentation de 0,25 d’OR. Le score PREVALENT attribuait ainsi 1 point par chaque incrément de 5 ans d’âge, 2 points pour des antécédents de tabagisme, 7 points pour le tabagisme actif, 3 points pour une HTA non prise en charge, 1 point pour une HTA correctement traitée. Quand le score était supérieur à 7, sur 4 patients examinés, un avait une AOMI asymptomatique. En revanche, il n’y avait pas d’association spécifique entre le diabète pris isolément et l’AOMI asymptomatique, ce qui peut surprendre car le diabète est un facteur de risque classique de l’AOMI.
En utilisant le score PREVALENT, le médecin généraliste peut plus facilement identifier les patients chez qui il sera utile de mesurer l’IPS, en vue d’une adaptation de la prise en charge.
Dépistage de l’anévrisme de l’aorte abdominale par écho-Doppler : un bénéfice médico-économique démontré sur la mortalité à long terme
L’échographie abdominale a bouleversé le dépistage de l’anévrisme de l’aorte abdominale (AAA) ; elle s’est imposée comme le mode usuel de dépistage. La mortalité des AAA rompus reste majeure (65 à 90 %), justifiant le dépistage. Peu symptomatique ou l’étant tardivement, l’AAA est communément appelé le « tueur silencieux ». La prévalence de l’AAA augmente de façon linéaire avec l’âge à partir de 60 ans. Le risque de rupture croît avec le diamètre antéropostérieur de l’anévrisme, avec une valeur seuil de 40 mm (figure 2). D’autres facteurs de progression sont impliqués : l’HTA non contrôlée ; la BPCO sévère ; le tabagisme (facteur de croissance de l’AAA) ; la forme de l’AAA (sacciforme ou surtout excentré) ; la vitesse de croissance > 6 mm par an ; les antécédents familiaux d’AAA. La femme est moins exposée à l’AAA, mais le risque de rupture est plus rapide à partir de 40 mm.
Figure 2. Coupe transversale échographique d’un anévrisme de l’aorte abdominale.
Les recommandations de la SFMV
Ce sujet est particulièrement d’actualité puisque l’année dernière, la Société française de médecine vasculaire (SFMV) a publié des recommandations sur le dépistage de l’AAA(5). La SFMV recommande de procéder au dépistage de l’anévrisme chez tous les hommes de 60 à 75 ans fumeurs ou anciens fumeurs, conseille ce dépistage chez tous les hommes de 60 à 75 ans non fumeurs, chez les femmes de 60 à 75 ans tabagiques ou hypertendues ; chez les hommes et femmes de plus de 75 ans, tabagiques, sans co-morbidité lourde et ayant une espérance de vie sensiblement normale pour l’âge. Enfin, il est recommandé de dépister l’AAA chez les hommes et les femmes de plus de 50 ans ayant une histoire familiale d’AAA au premier degré, ce, d’autant que plusieurs collatéraux auront été touchés. Le décor est donc planté et une équipe anglaise vient de confirmer le bénéfice médicoéconomique du dépistage tout au moins chez l’homme de plus de 65 ans dans la revue Annals of Internal Medicine.
L’efficacité du dépistage est confirmée
Il s’agit de la poursuite de l’étude du registre MASS (Multicentre Aneurysm Screening Study) dont les résultats à 4 ans ont déjà été publiés.
Cette étude multicentrique s’est intéressée au bénéfice plus tardif à 7 ans du dépistage de l’AAA par écho-Doppler dans une population de 67 770 hommes âgés de 65 à 75 ans, invités à se présenter entre 1997 et 1999. Un suivi trimestriel par écho-Doppler était ensuite réalisé.
À 4 ans, on constatait une réduction significative de la mortalité de 42 % et une augmentation du rapport coût-efficacité de 55 300 dollars par année de vie sauvée (IC 95%: 29 700- 295 300).
À 7 ans, on notait un total de 105 décès attribuables à l’AAA dans le groupe suivi (n = 33 883), contre 196 dans le groupe témoin (n = 33 387), soit un hazard ratio (HR) de 0,52 (IC 95 % : 0,42-0,64), un nombre total de rupture d’AAA de 135 dans le groupe suivi contre 257 dans le groupe témoin, soit un HR de 0,52 (IC 95 % : 0,42-0,64).
Il n’y avait pas de différence significative sur la mortalité par autres événements CV ou par cancer. On notait un taux moindre de décès totaux dans le groupe suivi avec un HR : 0,96 [0,93-1] et une possible réduction des décès par ischémie myocardique (HR = 0,93 [0,87-1]).
Le dépistage et le suivi ont permis de réduire en moyenne de moitié la mortalité par rupture d’AAA à 7 ans. L’étude des courbes actuarielles de survie notait un bénéfice dès la 1re année de suivi, bénéfice qui s’accentuait encore dès la 5e année de suivi. On a constaté aussi une augmentation du ratio coût/efficacité de la mortalité par AAA à 7 ans de 19 500 $ par année de vie sauvée (IC 95%: 12 500-39 800 $), intervalle de confiance beaucoup plus restreint.
Une des limites de cette étude est qu’il n’y a pas eu d’évaluation d’un bénéfice du dépistage chez la femme – on sait qu’elle tire aussi un bénéfice du dépistage après 65 ans – et/ou en présence d’autres facteurs de risque cardiovasculaires. Une autre limite est la non-exclusion des décès par rupture d’anévrisme thoracique, qui n’a pas fait l’objet de dépistage spécifique préalable, ce qui a pu fausser l’évaluation du bénéfice du traitement.
Cette étude randomisée contrôlée confirme le bénéfice médico-économique à long terme du dépistage de l’AAA par écho-Doppler chez l’homme de plus de 65 ans. La plupart des études de suivi se sont limitées à une durée de 4 ans. Des études complémentaires seront intéressantes dans d’autres sous-groupes à risque d’AAA, en particulier les femmes. Voilà de quoi faire évoluer encore nos pratiques professionnelles et être plus systématiques dans le dépistage de cette affection chez nos patients à risque cardiovasculaire.
Le syndrome métabolique : un catalyseur du risque d’événements cardiovasculaires chez l’hypertendu
Un travail publié récemment dans l’American Journal of Hypertension s’est intéressé aux liens potentiels entre la présence d’un syndrome métabolique (SM), défini selon les critères NCEP-ATP III (figure 3) et la présence de complications CV chez des hypertendus traités et non traités. Il s’agissait de patients du registre ETODH (Evaluation of Target Organ Damage in Hypertension). Les patients ont été classés en trois groupes d’âge : groupe I : 17-40 ans ; groupe II : 41-64 ans ; groupe III : > 64 ans.
Figure 3. Syndrome métabolique : critères ATP III.
L’hypertrophie ventriculaire gauche (HVG), la microalbuminurie et la présence d’une épaisseur intima-média (EIM) ≥ 8 mm ou de plaques carotidiennes seraient plus fréquentes chez le patient hypertendu en présence d’un SM, aggravant son pronostic CV.
Dans cette étude, le risque d’HGV, d’anomalies carotidiennes et de microalbuminurie est multiplié respectivement par 2,5 (p = 0,003), 2,2 (p = 0,0005 et (p = 0,01) en présence d’un SM, avec des prévalences de l’HVG, de l’épaisseur intima-média et de la microalbuminurie plus élevées en présence d’un syndrome métabolique dans toutes les tranches d’âge étudiées (tableau).
En regardant l’effet propre de chacun des composants du SM, il s’avérait que l’obésité abdominale était le seul marqueur clinique indépendant de la présence d’une HVG (OR : 2,1 ; IC : 1,05-3,91) et l’élévation de la glycémie (≥ 1,10 g/l) était le seul marqueur indépendant de la microalbuminurie (OR : 1,9 ; IC : 1,09-4,05). Aucun des composants n’était un marqueur indépendant de l’EIM. Le SM et l’âge avaient un effet cumulatif délétère sur la survenue de complications CV et rénales chez le patient hypertendu, chez l’homme comme chez la femme, majorant leur risque d’événements cliniques CV. La prévalence des différents composants du SM augmentait avec l’âge, hormis le HDL-cholestérol.
Ces données doivent être prises en considération dans le cadre de la prévention primaire chez l’hypertendu dès le plus jeune âge. La recherche de complications CV devrait être plus intensive en présence d’un SM, qui doit être considéré comme une véritable loupe clinique du risque CV. Le SM est une véritable situation clinique à risque permettant de sélectionner les patients qui doivent bénéficier d’une intensification de leur prise en charge(7).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :