Publié le 02 mai 2006Lecture 7 min
Le thrombus en salle de cardiologie interventionnelle
P. AUBRY, hôpital Bichat-Claude Bernard, Paris et B. Livarek, hôpital André Mignot, Le Chesnay
Congrès francophone de cardiologie interventionnelle
Parmi ses deux composantes pariétale et luminale, c’est la thrombose qui fait tout la gravité d’une lésion coronaire du fait de son caractère imprévisible et de son évolution parfois explosive. La prise en charge thérapeutique de la maladie coronaire se doit de la limiter et de la réduire dans les syndromes coronaires aigus (SCA) et de la prévenir après une intervention coronaire percutanée (ICP).
Le Groupe de réflexion sur la cardiologie interventionnelle (GRCI) a organisé une session consacrée à la conduite pratique à tenir en cas de présence d’un thrombus intracoronaire au cours d’une ICP. Les cardiologues interventionnels sont régulièrement confrontés à ce problème en raison de la proportion importante de SCA pris en charge de plus en plus précocement.
La reconnaissance angiographique d’un thrombus n’est pas toujours évidente mais sa présence ne peut être mise en doute sur les données physiopathologiques montrant qu’un processus thrombotique est un élément primordial dans la survenue d’un SCA. La présence d’un thrombus est reconnue comme un facteur pronostique péjoratif au cours des ICP avec une augmentation du risque d’occlusion aiguë postprocédurale mais également avec un pronostic moins bon à 6 mois (figure 1).
Figure 1. Courbe Kaplan-Meier représentant la probabilité de décès par infarctus à 6 mois selon la présence ou non d’un thrombus angiographique avant une ICP : analyse rétrospective de 6 études regroupant 7 917 patients (Singh M et al. JACC 2001).
Thrombus et syndromes coronaires aigus ST+ : thrombus toujours présent
Dans les SCA ST+, la réduction spontanée ou pharmacologique du processus thrombotique est associée avant une ICP à un meilleur pronostic à 6 mois, comme le montrent les études PAMI sur l’angioplastie primaire (figure 2). La mortalité est très basse (0,5 %) en cas de flux TIMI normal, mais passe à 4,4 % en cas flux TIMI 0 ou 1.
Figure 2. Courbe de survie après une angioplastie primaire pour SCA ST+ stratifiée selon le grade de perfusion coronaire (TIMI) observé avant l’ICP (données des 4 études PAMI chez 2 327 patients [Stone GW et al. Circulation 2001]).
Aspirine et héparines
Certains médicaments utilisés régulièrement au cours des ICP comme l’aspirine et les héparines (non fractionnée ou de bas poids moléculaire) n’ont pas démontré d’impact significatif sur la réduction de la taille d’un thrombus lors des SCA ST+, mais ils gardent leur place pour diminuer le risque de réocclusion précoce et prévenir la formation de thrombus au niveau des matériaux introduits par voie endovasculaire.
Autres antiplaquettaires
D’autres agents antiplaquettaires peuvent être utilisés comme le clopidogrel ou les bloqueurs des récepteurs glycoprotéiques plaquettaires IIb/IIIa (anti-GPIIb/IIIa). Certaines données incitent à leur utilisation la plus précoce possible, comme l’étude PCI-CLARITY (CLopidogrel as Adjunctive ReperfusIon TherapY: Percutaneous Coronary Intervention subgroup study) montrant un effet clinique bénéfique de l’administration du clopidogrel (300 mg) dans les 45 min suivant une fibrinolyse (figure 3).
Le taux d’artères ouvertes avant l’ICP était plus élevé dans le groupe clopidogrel (86,9 vs 80,8 % dans le groupe témoin, p < 0,001) mais avec un contrôle angiographique relativement tardif (médiane à 3 jours). L’abciximab est l’anti-GPIIb/IIIa qui a été le plus étudié dans les SCA ST+ avec des effets bénéfiques sur une métaanalyse incluant 5 études et 3 666 patients (figure 4).
Figure 3. Effets d’un prétraitement par clopidogrel (300 puis 75 mg/j) avant une ICP chez 1 863 patients avec SCA ST+ ayant bénéficié d’une thrombolyse (Sabatine MC et al. JAMA 2005).
Figure 4. Effets d’un traitement par abciximab associé à une angioplastie primaire chez 3 666 patients avec SCA ST+ (Topol EJ et al. JACC 2003).
La question en suspens (mais qui ne semble plus en être une pour certaines équipes) est de savoir s’il n’est pas souhaitable de donner l’anti-GPIIb/IIIa le plus tôt possible, c’est-à-dire en phase préhospitalière, sous la responsabilité des équipes d’urgence médicalisées.
Thromboaspiration
À côté des traitements pharmacologiques, nous disposons aussi d’outils permettant une thromboaspiration dans le but de réduire la masse thrombotique et de limiter les risques de migration distale. Leur efficacité angiographique a été largement rapportée (figures 5 à 7) permettant une amélioration de la qualité du flux épicardique, mais il reste à définir leur place exacte au cours des ICP car une utilisation systématique n’est pas toujours associée à une réduction significative des événements cardiaques sévères, telle la mortalité (mais souvent en raison d’effectifs de taille insuffisante).
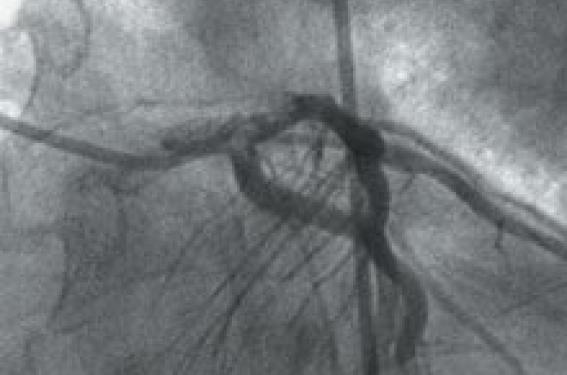
Figure 5. Important thrombus dans le tronc commun et l’origine de l’IVA et de la circonflexe au cours d’un infarctus antérieur aigu.
Figure 6. Cathéter d’aspiration.
Figure 7. Aspect angiographique après utilisation d’un cathéter d’aspiration.
Thrombus et syndromes coronaires aigus ST- : thrombus souvent présent
Dans les SCA ST-, la stratification du risque est essentielle, permettant d’adapter une stratégie thérapeutique plus ou moins agressive. Le dosage répété des enzymes cardiaques comme la troponine aide à évaluer ce risque. Un thrombus est visuellement plus fréquent en cas de troponine élevée (figure 8). La fragmentation partielle du thrombus peut expliquer les nécroses myocardiques enzymatiques dans les SCA ST- par des microembolies répétées.
Figure 8. Incidence angiographique d’un thrombus en fonction du taux de troponine Ic chez 100 patients avec SCA ST- (Benamer H et al. Am Heart J 1999).
Privilégier les anti-GPIIb/IIIa
La très grande majorité des études testant l’efficacité des anti-GPIIb/IIIa dans les SCA ST- est en faveur de l’utilisation de cette classe thérapeutique avant une ICP (figure 9).
Figure 9. Principales études avec les anti-GPIIb/IIIa dans les SCA ST-.
Le concept pharmacologique peut s’expliquer par un meilleur contrôle du phénomène thrombotique au niveau de la lésion coupable avec une diminution du risque embolique. Aussi l’utilisation des anti-GPIIb/IIIa est-elle conseillée (classe 1C) pour les SCA ST- à haut risque dans les dernières recommandations européennes si une ICP est prévue ou réalisée. Néanmoins, les audits révèlent généralement une sous-utilisation de cette classe antithrombotique pouvant s’expliquer par l’ancienneté de certaines études avec un taux de stenting parfois bas et une absence de prétraitement par le clopidogrel. Lorsque ce dernier n’est pas administré avant une ICP, l’adjonction d’un anti-GPIIb/IIIa permet une meilleure inhibition de l’agrégation plaquettaire (figure 10).
Figure 10. Inhibition plaquettaire sous ADP dans 4 groupes de traitement après une ICP avec stenting chez 120 patients (Grubel PA et al. Circulation 2005).
Thrombus et prothèses endocoronaires : thrombose massive
Le problème de la thrombose d’endoprothèse est né avec les endoprothèses et demeurera tant que leur implantation fera partie de l’arsenal thérapeutique du cardiologue interventionnel.
À côté des thromboses aiguës (< 48 h) liées souvent à une mauvaise apposition de la prothèse ou à une dissection non couverte, et des thromboses subaiguës (< 30 j) en rapport avec une inhibition plaquettaire insuffisante alors que l’endothélialisation débute à peine, des observations sont rapportées désormais régulièrement sur des thromboses plus tardives (parfois au-delà d’une année) depuis l’apparition des prothèses actives et des traitements anti-plaquettaires prolongés qu’il est parfois nécessaire de réduire ou d’interrompre. Si la fréquence de ces thromboses reste heureusement faible (< 2 %), elles demeurent graves avec un taux cumulé de décès et d’infarctus Q > 35 % (tableau 1).
Facteurs prédictifs des thromboses
Les prothèses actives ne présentent pas de risque supplémentaire au cours du 1er mois. L’arrêt du traitement antiplaquettaire est le facteur prédictif le plus souvent retrouvé. L’insuffisance rénale, le diabète, les lésions de bifurcation et une FE basse sont aussi des facteurs prédictifs (tableau 2). Il est souvent souligné que les taux de thrombose après pose d’une prothèse active rapportés dans les registres dans certaines populations sont supérieurs à ceux observés dans les études contrôlées. Par exemple, le registre EVASTENT (cost-effectiveness analysis of the sirolimus active stent in diabetic and non-diabetic patients) qui a inclus 1 741 patients, montre à 30 jours un taux de thrombose de 2,3 % chez les diabétiques multitronculaires comparé à un taux de 0,4 % chez les non-diabétiques monotronculaires.
La prise en charge interventionnelle de patients diabétiques avec des lésions complexes les expose à des risques manifestement plus élevés et doit faire discuter soit une technique de revascularisation alternative, soit une stratégie interventionnelle en plusieurs étapes en s’assurant d’une efficacité biologique du traitement antiplaquettaire.
Du fait de sa gravité et de ses mécanismes, il convient de pouvoir utiliser, en cas de thrombose sur endoprothèse, tout l’arsenal thérapeutique mécanique et pharmacologique (en particulier les anti-GPIIb/IIIa) à disposition dans les salles de cardiologie interventionnelle.
Thrombus et pontages coronaires veineux
L’angioplastie des greffons veineux représente toujours une procédure complexe en raison de la composition même des lésions associant des thrombi et des éléments fibreux (tableau 3) qui ont la particularité d’être friables et peu adhérents avec un risque majeur d’embolisation distale.
Les anti-GPIIb/IIIa n’ont pas montré jusqu’à présent un avantage significatif dans cette indication et les cardiologues interventionnels se sont tournés vers des solutions plutôt mécaniques comme le stenting direct (en évitant les hautes pressions) et les systèmes de protection distale.
Nous disposons d’une étude randomisée montrant l’effet bénéfique d’un système de protection (Guardwire™) au cours d’une angioplastie d’un greffon veineux (tableau 4). D’autres systèmes plus simples comme le Filterwire™ ont une efficacité comparable (figure 11). Aussi, l’utilisation, lorsqu’elle est techniquement possible, d’un système de protection (figure 12) est fortement conseillée (classe 1A) dans les recommandations européennes.
Figure 11. Critères primaires à 30 jours de l’étude FIRE comparant le Filterwire et le Guardwire dans l’angioplastie de greffons veineux (Stone GW. et al. Circulation 2003).
Figure 12. Filtre de protection.
En pratique
Le thrombus, même s’il n’est pas ou peu angiographiquement visible, doit être considéré comme un adversaire permanent du cardiologue interventionnel qui dispose maintenant d’une vaste panoplie d’outils mécaniques et pharmacologiques pour un traitement efficace.
La question sans doute la plus difficile en pratique actuelle est de savoir dans quel ordre il convient de les utiliser afin de ne pas compliquer inutilement une procédure interventionnelle tout en évitant de faire l’impasse sur un produit ou un outil performant et validé.
Avec la participation des Prs J. Monségu, G. Montalescot, E. Teiger et les Drs H. Benamer et K. Boughalem
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :