Publié le 13 mar 2007Lecture 15 min
Cardiologie pédiatrique : du dépistage in utero à l'âge adulte
J.-B. THAMBO, hôpital du Haut-Lévêque, Pessac
Les Journées écho-Doppler cardiovasculaire de Bordeaux
La session de cardiologie pédiatrique a permis à M. Jimenez (Bordeaux) de rappeler les indications et l’utilité de l’échocardiographie cardiaque fœtale pour dépister non seulement les malformations cardiaques les plus graves qui peuvent faire recourir à une interruption thérapeutique de grossesse, mais aussi de dépister les cardiopathies congénitales afin d’améliorer la prise en charge de ces enfants dès la naissance pour leur donner un maximum de chances.
L’échocardiographie fœtale : un examen d’expert
C’est une discipline qui nécessite une connaissance parfaite de l’anatomie et de la physiologie de la circulation cardiaque fœtale, mais également des cardiopathies congénitales sous toutes leurs formes. Ces éléments sont indispensables pour appréhender l’étude du cœur fœtal, donner un diagnostic précis et une conduite à tenir à nos collègues obstétriciens et radiologues, mais également conseiller et aider les parents. La performance de cet examen très spécialisé dans la détection des anomalies cardiaques fœtales dépend beaucoup du dépistage de première intention pratiqué par les gynécologues.
Les buts de l’échocardiographie fœtale sont de détecter :
- les cardiopathies majeures non réparables ;
- les cardiopathies à haut risque d’anomalies chromosomiques ou extracardiaques associées ;
- les cardiopathies nécessitant une prise en charge néonatale précoce ;
- l’analyse des arythmies fœtales ;
- l’évaluation de la fonction cardiaque fœtale : dysfonction cardiaque secondaire à une maladie fœto-maternelle (retard de croissance intra-utérin, jumeaux transfuseur-transfusé, etc.).
L’analyse du cœur fœtal doit être séquentielle (réalisée à 18 – 20 semaines d’aménorrhée) :
- position du cœur dans le thorax ;
- situs auriculaire (oreillette droite recevant les veines sus-hépatiques) ;
- concordance auriculo-ventriculaire (OG-VG, OD-VD) ;
- concordance ventriculo-artérielle (VD-AP, VG-Ao) ;
- taille du cœur et de chacune des cavités et des vaisseaux ;
- taille du foramen ovale perméable et du canal artériel ;
- contractilité ventriculaire.
Cette analyse séquentielle et systématique doit être enseignée aux échographistes pratiquant des échographies morphologiques de premier niveau (obstétriciens, radiologues), ce qui permet d’améliorer, en créant un réseau, le taux de détection des cardiopathies congénitales. Le diagnostic exact et le pronostic de la malformation sont du domaine du cardio-pédiatre.
Les anomalies coronaires : pathologies de l’enfant et de l’adulte
A. Bozio (Lyon) nous a présenté un florilège d’anomalies coronaires de l’enfant mais aussi de l’adulte. Les nouvelles méthodes d’exploration non invasives qui existent aujourd’hui permettent de diagnostiquer assez précisément les anomalies des artères coronaires qui peuvent être acquises ou congénitales.
Les anomalies acquises : à côté du syndrome de Kawasaki ou des autres artériopathies qui se rencontrent plus rarement chez le sujet jeune (Takayashu, Fabry, Tangier, mucopolysaccharidoses, artériopathie calcifiante, alcaptonurie), figurent aujourd’hui les anomalies secondaires à un geste chirurgical tels que la mobilisation ou le transfert des artères coronaires (correction artérielle de la transposition des gros vaisseaux, interventions de Ross ou de Bentall). Ces anomalies doivent être systématiquement recherchées après de telles opérations et notamment lorsque l’intervention chirurgicale initiale s’est heurtée à une anomalie congénitale de la coronaire native et en particulier un trajet intrapariétal aortique.
Les anomalies congénitales s’expliquent par la complexité des phénomènes d’angiogenèse aboutissant à l’incorporation du plexus vasculaire du myocarde primitif à l’aorte pour former les artères coronaires. La classification anatomique détaillée d’Angelini (Circulation 2002) rend compte de l’extraordinaire polymorphisme anatomique et physiopathologique des anomalies coronaires. Il paraît plus simple de classer ces anomalies en fonction des problèmes cliniques rencontrés.
Les anomalies associées aux cardiopathies congénitales. Elles posent le problème du diagnostic préopératoire des formes présentant un risque chirurgical ou pouvant modifier la tactique chirurgicale. L’échocardiographie est devenue la technique de base du diagnostic de ces anomalies et, malgré les pièges que comporte l’utilisation d’une technique tomographique pour l’étude d’une structure vasculaire arborescente, la qualité des informations fournies sur le plan anatomique et physiopathologique est généralement suffisante chez le nouveau-né et le nourrisson. Les nouvelles techniques d’imagerie par IRM ou scanner à haute définition viennent compléter les données ultrasonores chez le grand enfant ou l’adolescent et permettent d’éviter dans la majorité des cas une étude coronarographique systématique qui reste indispensable lorsque les données de l’imagerie non invasive sont ambiguës.
On les recherchera plus particulièrement dans :
– la transposition des gros vaisseaux,
– les cardiopathies,
– les sténoses aortiques valvulaires mais surtout supravalvulaires,
– les atrésies pulmonaires à septum ouvert.
Les anomalies associées aux myocardiopathies. L’hypoplasie du réseau coronaire, l’atrésie ostiale dans les myocardiopathies dilatées ou les ponts myocardiopathies hypertrophiques peuvent jouer un rôle dans la mort subite. Ces anomalies sont évoquées à l’écho-Doppler par une accélération du flux coronaire mais sont en majeure partie diagnostiqués par l’IRM.
Les anomalies de naissance des coronaires peuvent être isolées. Les coronaires peuvent effectivement naître en position anormale, soit de l’artère pulmonaire, soit de l’aorte.
Lorsqu’elles naissent de l’artère pulmonaire, c’est habituellement le tronc coronaire gauche qui naît du sinus pulmonaire postérieur gauche réalisant, dans certains cas chez le nourrisson, le typique « angor du biberon ». Le tableau est celui d’une dysfonction ventriculaire gauche d’apparition progressive où l’insuffisance mitrale ischémique peut être au premier plan. Initialement, tant que les pressions pulmonaires sont élevées, le flux est antérograde, puis au fur et à mesure que les pressions pulmonaires diminuent, le flux de la coronaire gauche s’inverse pour réaliser un shunt gauche-droit au niveau de l’artère pulmonaire, alimenté par le réseau coronaire droit à travers des anastomoses D/G dont l’importance conditionne le degré d’ischémie myocardique ventriculaire gauche.
L’association de cette anomalie avec un shunt gauche droit hypertensif vicariant (CIA, CIV, CAP) est possible mais rare. Dans ce cas précis, la suppression de ce shunt peut entraîner une évolution myocardique catastrophique.
Toutes les formes cliniques depuis le tableau de myocarde hibernant jusqu’à celui de la nécrose myocardique compliquée d’anévrisme ou de rupture pariétale sont possibles.
Si l’aspect électrocardiographique est celui d’une nécrose myocardique, le diagnostic repose sur l’échocardiographie et la détection par le Doppler couleur de l’inversion du flux dans le réseau coronaire gauche, en particulier au niveau des artères septales et du shunt G/D au niveau de la zone d’abouchement dans l’AP.
Le caractère asymétrique de la dysfonction ventriculaire gauche, l’existence d’une insuffisance mitrale ou la détection de zones de sclérose, en particulier sur le pilier mitral antérolatéral, sont des éléments d’orientation. Le traitement consiste à réimplanter chirurgicalement la coronaire gauche dans l’aorte pour rétablir une perfusion myocardique à deux coronaires. La ligature isolée de la coronaire anormale à son abouchement peut être bien tolérée dans les formes à bonne collatéralité et à shunt G/D important. Cette revascularisation myocardique s’accompagne dans la majorité des cas d’une régression de la dysfonction VG témoin du caractère hibernant du myocarde, mais la possibilité de lésions séquellaires définitives justifie une surveillance à long terme. L’importance de la collatéralité entre la coronaire droite et le réseau gauche expliquent les formes à bonne tolérance et à fonction VG sub-normale que l’on peut dépister chez l’adolescent ou l’adulte à l’occasion d’un bilan de souffle.
Les anomalies de naissance des coronaires à partir de l’aorte, longtemps considérées comme des curiosités rares sans conséquences cliniques sont actuellement reconnues comme potentiellement dangereuses car à l’origine de morts subites.
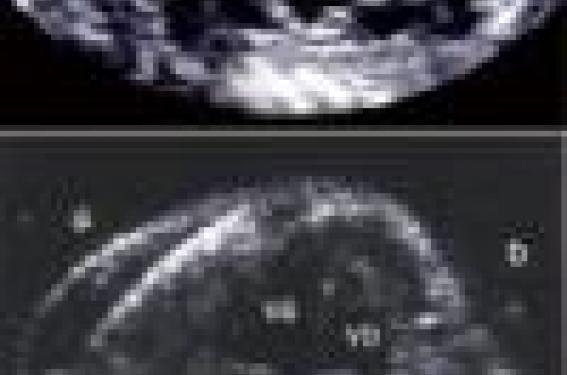
La naissance de la coronaire gauche du sinus droit (figure 1) et la naissance de la coronaire droite du sinus gauche sont les plus fréquemment rencontrées dans les morts subites du sujet jeune en particulier à l’effort.
L’existence d’un ostium en fente, d’une valve ostiale, d’une naissance tangentielle ou d’un trajet intrapariétal aortique et interaortico-pulmonaire sont autant de mécanismes invoqués pour expliquer la survenue d’une ischémie myocardique paroxystique à l’origine des accidents subits. Le diagnostic peut être fait par échocardiographie Doppler couleur orientée et par scanner de haute définition. Il est fréquent que les tests de détection de l’ischémie myocardique à l’effort chez les patients ayant eu des symptômes avant l’accident subit restent négatifs. Le traitement chirurgical consiste, là encore, en une réimplantation de la coronaire anormale dans l’aorte. Il existe encore une forme de naissance anormale de la coronaire gauche du sinus droit avec un trajet intra-infundibulaire.
Figure 1. Naissance anormale de la coronaire gauche (CG) à partir du sinus droit avec trajet inter-aortico-pulmonaire. Le flux de la coronaire s’éloignant du transducteur (en bleu) est détecté par le Doppler couleur car le flux est dans l’axe des ultrasons émis. AO : aorte ; AP : artère pulmonaire.
Les fistules coronaro-camérales peuvent être isolées : elles constituent une communication entre une branche coronaire droite ou gauche et une cavité cardiaque, le plus souvent l’oreillette ou le ventricule droit, mais également l’artère pulmonaire, voire le ventricule gauche. Une insuffisance cardiaque peut s’observer chez le nourrisson en raison de l’hyperdébit du shunt G/D, mais une régression spontanée peut s’observer. Chez l’enfant plus grand et chez l’adulte, la symptomatologie est souvent réduite et l’auscultation montre un souffle continu. L’échocardiographie Doppler couleur est productive pour détecter la coronaire dilatée qui alimente la fistule et localiser la zone d’abouchement anormale. Certaines formes anatomiques sont accessibles à une occlusion par voie percutanée avec des dispositifs largables, mais les indications restent discutables.
Bicuspidie aortique et pathologie de l’aorte ascendante
La prévalence de la bicuspidie aortique est classiquement de 1 à 2 %, probablement un peu moins, avec prédominance masculine. Elle peut être isolée ou associée à une cardiopathie congénitale :
– sous-jacente : CIV ; sténose sous-valvulaire ;
– sus-jacente : sténose supra-valvulaire ; coarctation ; arc aortique ; canal artériel persistant ;
– syndrome de Turner.
J.-R. Lusson (Clermont-Ferrand) exposé que la dilatation de l’aorte ascendante avec son potentiel évolutif n’est pas une coïncidence, ni une conséquence de la dysfonction valvulaire. L’étiologie embryologique commune des cellules mésenchymateuses, leur évolution apoptotique et les constituants de la matrice extracellulaire sont autant d’arguments explicatifs.
L’échocardiographie Doppler est l’examen de choix pour le diagnostic positif de l’anomalie valvulaire et de sa dysfonction. Si une imagerie comparative est souvent nécessaire (IRM ou scanner), la détection de la dilatation de l’aorte ascendante est bien faite par les différentes mesures échographiques des diamètres (anneau, sinus, jonction sinotubulaire et tubulaire.
Si une valve bicuspide peut avoir une fonction normale, elle peut être responsable d’une fuite et plus souvent d’un rétrécissement. Le rétrécissement dégénératif est plus fréquent et plus rapide que sur valve normale.
Les indications thérapeutiques découlent du suivi clinique et échocardiographique. Plusieurs situations sont rencontrées avec des propositions chirurgicales différentes (tableau).
Les myocardiopathies hypertrophiques (MCH)
Comme l’a rapporté J.-B. Thambo (Bordeaux) Elles sont une cause commune de mort subite chez l’enfant et l’adolescent. Qu’elles soient d’origine familiale à transmission autosomique dominante avec une pénétrance liée à l’âge ou métabolique par déficit du métabolisme oxydatif, il est indispensable de poser le diagnostic le plus tôt possible. Les thérapeutiques disponibles sont rarement curatives, mais le fait de poser le diagnostic permet de conseiller les familles et de dépister les apparentés asymptomatiques lorsqu’il s’agit d’une affection à transmission mendélienne ou mitochondriale.
Depuis quelques années la génétique a profondément modifié notre connaissance de ces affections et apparaît comme étant un des outils incontournables pour prendre en charge la dimension familiale de la maladie et déterminer quels sont les apparentés à risque suffisant pour justifier une surveillance médicale spécialisée et surtout une prise en charge précoce. Si, dans la MCH, certaines mutations comme celles sur la troponine T ont un risque élevé de mort subite en comparaison avec d’autres mutations, il est encore trop tôt pour définir une attitude thérapeutique concernant ce type de corrélation génotype/phénotype.
À côté des formes classiques autosomiques dominantes qui touchent les gènes codants pour les protéines contractiles du myocyte, les myocardiopathies métaboliques sont une cause non négligeable d’atteinte cardiaque diagnostiquée chez l’enfant. Dans la majorité des cas, elles s’intègrent dans une atteinte multisystémique, ce qui rend plus aisé le diagnostic, mais elles peuvent aussi se manifester de façon isolée. La prévalence des cytopathies mitochondriales est d’environ 5/100 000 et la fréquence de l’atteinte cardiaque serait de 25 %. L’anomalie responsable est présente dès la naissance mais la myocardiopathie peut se révéler à divers âges de la vie. Elle s’inscrit dans une atteinte multisystémique dont les principaux organes atteints sont le système endocrinien (diabètes mitochondriaux), l’organe de Corti (surdités bilatérales neurosensorielles), la vision (dystrophie maculaire rétiniennes), les muscles (myopathies caractérisées par les classiques fibres rouges déchiquetées), le système nerveux (syndrome de Melas, syndrome de Merrf, syndrome de Kearns-Sayre) et le rein (insuffisance rénale). Les divers mécanismes impliqués sont présentés sur la figure 2. La présentation échographique habituelle de ces myocardiopathies est celle d’une myocardiopathie hypertrophique dans la majorité des cas (figure 3). Aucun aspect échographique pathognomonique n’a cependant été décrit.
Figure 2. Myocardiopathie métabolique = myocardiopathie par atteinte des mécanismes essentiels du métabolisme myocardique : divers mécanismes sont possibles.
Figure 3. Aspect de myocardiopathie hypertrophique obstructive chez un adolescent de 14 ans. L’épaisseur septale dépasse 30 mm.
La recherche de signes de gravité est la même que dans les autres formes de myocardiopathies et le pronostic, même s’il est souvent cardiaque, le plus souvent dépend de l’atteinte des autres organes. L’échographie reste donc l’outil indispensable au diagnostic et au recueil des données utiles aussi bien à la stratification du risque et à l’orientation thérapeutique qu’au dépistage et au diagnostic précoce des patients présymptomatiques. La mesure d’une épaisseur septale > 3 cm ou la recherche d’un gradient intraventriculaire gauche au repos ou après épreuve de provocation > 30 mmHg restent des éléments fondamentaux à rechercher et à préciser de façon systématique tant ils semblent être prédictifs d’accident grave. La mise en évidence d’une dysfonction diastolique ou la détection en Doppler tissulaire d’une dysfonction myocardique à un stade préclinique sont des données qui peuvent être utilisées pour identifier les « porteurs sains ».
Figure 4. Mise en place d’une prothèse de fermeture de CIA sous ETO.
Suivi du Fallot à l’âge adulte
La tétralogie de Fallot (TDF) est la cardiopathie cyanogène la plus fréquente (5 à 9 % des cardiopathies congénitales) a été traitée par P. Guérin (Nantes). Si la description, le diagnostic et le traitement chirurgical sont très bien codifiés de nos jours, l’évolution au long cours et les complications que l’on voit apparaître au cours du suivi de ces patients opérés après plusieurs décennies sont importantes à définir et à identifier pour bien codifier la prise en charge de ces patients.
La TDF associe une communication interventriculaire (CIV), une sténose pulmonaire, une dextroposition de l’aorte et une hypertrophie ventriculaire droite. Actuellement, en France, on peut estimer à environ 60 000 le nombre de patients adultes survivant avec une cardiopathie congénitale opérée, dont près d’un quart d’une TDF. Bien que l’évolution postopératoire soit excellente à long terme, les patients opérés n’ont pas un cœur anatomiquement et physiologiquement normal. Il est courant de constater à l’échographie une insuffisance pulmonaire (IP), une insuffisance tricuspide (IT), parfois des obstacles sur la voie pulmonaire, voire une CIV résiduelle. Ces anomalies semblent favoriser les troubles du rythme ventriculaire, via la surcharge du VD, pouvant aboutir à la survenue d’une mort subite (0,2 à 0,46 % par an).
Les fuites pulmonaires
L’utilisation de patch d’élargissement sur la voie pulmonaire (infundibulum, anneau, tronc de l’artère pulmonaire) a permis de limiter les obstacles résiduels mais leur utilisation favorise la survenue d’une IP, souvent importante, dont l’effet délétère à long terme est démontré. Une fuite est présente chez 80 % des patients corrigés mais son importance est variable. On admet aujourd’hui qu’un gradient résiduel modéré est mieux toléré à long terme qu’une IP importante sans sténose.
Les obstacles résiduels de la voie pulmonaire
Ces sténoses doivent être recherchées de façon systématique aux différents niveaux de la voie pulmonaire (infundibulum, anneau pulmonaire, tronc de l’artère pulmonaire, origine des branches pulmonaires). Elles peuvent être suspectées devant une élévation des pressions systoliques du ventricule droit estimées sur l’IT. Les sténoses périphériques des branches peuvent être congénitales ou acquises suite à la réalisation d’une anastomose systémico-pulmonaire (Blalock-Taussig) préalable à la correction de la cardiopathie. Dans ce dernier cas, elle siège au site d’implantation pulmonaire de l’anastomose.
La dilatation du ventricule droit
Il est possible d’observer une dilatation quasi-ectasique de l’infundibulum pulmonaire, secondaire au geste chirurgical de résection musculaire et à l’interposition d’un patch d’élargissement. Le plus souvent, la dilatation du VD traduit une surcharge systolique et/ou diastolique. Ainsi, une insuffisance pulmonaire significative va entraîner au long cours une dilatation du ventricule droit, puis une diminution de sa fonction et enfin sa défaillance. Les facteurs influant sur l’effet délétère de la fuite pulmonaire sont la relation entre la post-charge imposée par le lit vasculaire pulmonaire et la fonction diastolique du ventricule droit. Ainsi, tout obstacle pulmonaire périphérique va majorer la fraction de régurgitation.
Les communications interventriculaires résiduelles
Les CIV résiduelles ne sont pas rares mais le plus souvent petites et négligeables. Elles peuvent être congénitales ou résiduelles sur patch, siégeant souvent à proximité de l’anneau tricuspide.
L’insuffisance aortique
L’insuffisance aortique est possible mais rare. Elle survient d’autant plus que l’aorte est très dilatée (TDF : syndrome grosse aorte petite AP).
La dysfonction ventriculaire gauche
Elle est actuellement exceptionnelle après correction complète de la TDF. Elle était due autrefois aux dommages myocardiques liés à l’hypoxie des malaises anoxiques répétés en préopératoire et à la mauvaise protection myocardique lors des interventions chirurgicales. Cependant, elle peut exister chez des patients atteints de TDF non corrigée complètement et vivant sur une anastomose plus ou moins fonctionnelle.
Si la chirurgie correctrice de la TDF a permis une amélioration considérable de la qualité et de l’espérance de vie, la surveillance échographique régulière de ces patients doit être la règle. Elle peut permettre de déceler à temps une éventuelle défaillance du VD, souvent secondaire à une fuite et/ou à un obstacle résiduel sur la voie pulmonaire, pourvoyeuse d’insuffisance cardiaque droite et de troubles du rythme ventriculaire pouvant aboutir à une mort subite.
Sélection échocardiographique des CIA en vue d’une fermeture percutanée
Les communications interauriculaires (CIA) sont des malformations cardiaques fréquentes, dont le diagnostic a été facilité par l’échocardiographie. Même si la mise sur le marché de nouvelles prothèses pour occlure de tels défects a rendu ce geste simple et sûr, il peut apparaître tentant de fermer des CIA de plus en plus larges. Il en demeure cependant toujours vrai que certaines d’entre elles ne peuvent pas être fermées par voie percutanée. C. Rey (CHU de Lille) a exposé les critères qui permettent de déterminer les patients enfants ou adultes qui peuvent bénéficier de l’implantation d’un tel dispositif par voie percutanée sous ETO, voire sous écho endovasculaire.
Critères de non-sélection
L’ETT est habituellement suffisant pour éliminer les CIA qui ne peuvent pas être fermées par voie percutanée :
– la CIA de type ostium primum qui est un canal atrioventriculaire partiel visible en incidence des 4 cavités ;
– la CIA de type sinus venosus, haut située, sans rebord supérieur, souvent associée à un retour veineux pulmonaire anormal partiel supérieur droit. L’incidence apicale 4 cavités ou mieux sous-costale longitudinale passant par la veine cave supérieure droite en permettent le diagnostic ;
– la CIA « low septal defect », bas située, proche de la veine cave inférieure, visible en incidence sous-costale longitudinale par la veine cave inférieure ;
– la CIA de type sinus coronaire, très rare, qui est une déhiscence du toit du sinus coronaire faisant communiquer celui-ci avec l’oreillette gauche. Il s’y associe une veine cave supérieure gauche se drainant dans le sinus coronaire ;
– la CIA avec hypertension pulmonaire fixée.
Critères de sélection
Le diagnostic de CIA ostium secundum étant fait, il faut alors déterminer les conditions anatomiques favorables à la fermeture percutanée :
– le diamètre maximal de la CIA doit être évalué sur les différentes incidences en ETT et, si besoin, en ETO ;
– la longueur du septum interauriculaire (SIA) doit être suffisante pour implanter l’ombrelle. C’est souvent en incidence sous-costale que cette mesure est la plus grande ;
– la distance séparant les berges de la CIA des structures adjacentes, valves auriculo-ventriculaires, veines pulmonaires, sinus coronaire, veines caves, doit être au moins de 5 mm. En revanche, la berge rétro-aortique n’est pas indispensable si les autres rebords sont suffisants ;
– l’anatomie de la CIA doit être appréciée en ETO, voire par écho 3D ou échographie endovasculaire. Il est important de faire la différence entre une CIA en anneau de clé d’avec deux CIA. De même, un filament peut traverser la CIA et faire penser à deux CIA ;
– enfin, le dernier critère indispensable avant de fermer une CIA est la mesure du diamètre étiré en salle de cathétérisme. Ce diamètre guide le choix du dispositif et permet d’apprécier la solidité des berges ; l’épaisseur du SIA et sa mobilité sont à prendre en considération.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :