HTA
Publié le 10 jan 2012Lecture 12 min
Quelle démarche adopter devant une HTA associée à une hypokaliémie ?
J.-P. HAYMANN, UPMC, INSERM U702, Service d’Explorations Fonctionnelles, Hôpital Tenon, Paris
La démarche diagnostique proposée ici insiste sur le fait qu’une HTA associée à une hypokaliémie est, dans la majorité des cas, la signature d’une stimulation du système rénine angiotensine aldostérone (SRAA). L’arbre diagnostique, qui s’appuie sur le dosage plasmatique debout et couché de la rénine et de l’aldostérone et sur le ionogramme des urines de 24 heures, permet parfois de faire le diagnostic étiologique d’une HTA secondaire justifiant un traitement spécifique chirurgical ou médical.
Il permet également d’identifier chez des patients ayant une HTA « idiopathique » la cause de l’hypokaliémie, souvent d’origine rénale et iatrogène, et de pointer les anomalies du bilan du sodium qui peuvent expliquer souvent des HTA mal équilibrées. La réalisation répétée d’un ionogramme urinaire de 24 heures permettant d’évaluer les variations des apports en sodium est un des examens clés du diagnostic et du suivi.
Les différentes recommandations (OMS, JNC VII, ESH, ESC) imposent la réalisation d’un ionogramme sanguin chez les patients suivis pour HTA dans le but de rechercher une hypokaliémie.
Cette démarche permet de dépister des HTA associées à une stimulation du SRAA qui ont, comme nous le verrons ci-dessous, le plus souvent la caractéristique d’avoir un bilan sodé positif (en l’absence de traitement diurétique…). Ces informations seront utiles non seulement pour corriger l’hypokaliémie, c’est-à-dire dans le choix du traitement anti-HTA, mais pour identifier certaines étiologies d’HTA secondaires.
D’emblée, il est nécessaire d’avoir à l’esprit quelques notions simples, voire « simplistes » concernant les hypokaliémies :
• la carence d’apport en potassium n’existe pas. L’explication phylogénique avancée reste séduisante : nous avons, depuis la préhistoire, une alimentation riche en potassium (fruits ou baies sauvages, viandes crues ou cuites, etc.) ;
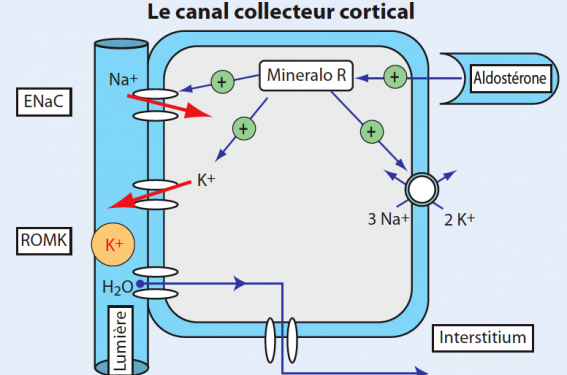
• le problème posé à notre organisme de façon quotidienne est donc davantage un problème d’excrétion que de réabsorption du potassium. Le problème est symétriquement opposé en ce qui concerne le sodium qui était, jusqu’à une période récente de l’histoire de l’Homme, peu présent dans l’alimentation. C’est au niveau du canal collecteur (CC) que l’aldostérone va permettre l’ajustement des sorties aux entrées de sodium, en réabsorbant plus ou moins de Na+ à partir de la lumière urinaire, la sécrétion/excrétion de potassium étant couplée à cette réabsorption (figure 1). Le potassium sert ainsi de variable d’ajustement dans la régulation du bilan du sodium ;
• la kaliémie dite « normale » varie en fonction des laboratoires d’analyse médicale entre 3,7 et 5,5 mmol/l. Les fluctuations peuvent provenir du mode de prélèvement (avec ou sans garrot), de l’alimentation (plus ou moins riche en sodium), d’une éventuelle fragilité des globules rouges (hémolyse mécanique lors du prélèvement ou dans le tube avant le dosage), enfin de l’automate réalisant la mesure… Le potassium est en effet un cation essentiellement intracellulaire dont la concentration est d’environ [K+]i = 100-110 mmol/l, le potassium extracellulaire constituant seulement 2 % du potassium de l’organisme. Une hypokaliémie < 3 mmol/l correspond généralement à un déficit de l’ordre de 200 mmol, soit entre 15 et 20 g de KCl(1-3). Pour mémoire, l’apport quotidien habituel est compris entre 70 et 100 mmol/j.
Figure 1. Représentation schématique d’une cellule principale du canal collecteur principal : mécanisme de réabsorption du sodium et de sécrétion du potassium.
MR : récepteur minéralocorticoïde ; ENaC : canal sodium apical (amiloride-sensible) ; ROMK : canal potassium.
Les limites de fonctionnement du rein normal : kaliurèse minimale et maximale
Le lien entre l’apport en sodium et l’excrétion rénale de potassium est un mécanisme essentiel et pourtant largement « oublié » dans la pratique médicale.
Lors d’une « mise au repos » du SRAA, lors d’une charge en sodium par exemple, le potassium excrété est proche de zéro (< 10-15 mmol/l). UK+ est la résultante de la quantité de potassium filtrée par jour (i.e., la charge filtrée est par exemple : 180 litres x 4 mmol/l soit 720 mmol/j) et de la quantité de K+ réabsorbée dans le tube contourné proximal et la partie du néphron distal en amont du canal collecteur qui est le lieu de sécrétion/excrétion du K+ dans la lumière urinaire. La réabsorption du K+, dans ces segments du néphron, est considérée comme secondaire à la réabsorption d’eau et des autres substances dissoutes, notamment le sodium. D’après ce qui précède, une hyperkaliémie vraie est donc nécessairement due soit à une diminution de la charge filtrée (insuffisance rénale), soit à une absence de sécrétion de potassium au niveau du canal collecteur (primitive ou secondaire à un hypoaldostéronisme).
Lors d’une activation du SRA primitive ou secondaire (à une hypovolémie), la sécrétion de potassium au niveau du canal collecteur peut en effet être considérable et atteindre 100 à 120 % de la charge filtrée, de l’ordre de 600 à 800 mmol/j, des quantités très largement supérieures aux apports alimentaires(1-4). La fuite rénale de potassium est alors responsable en quelques jours d’une hypokaliémie avec déficit en potassium intracellulaire associé (cf. supra).
Deux mécanismes de contre-régulation vont alors intervenir afin de limiter l’excrétion de potassium :
– une inhibition directe de l’aldostérone synthétisée et sécrétée au niveau des surrénales, expliquée par la diminution intracellulaire en potassium ;
– une baisse de la charge filtrée en cas d’hypovolémie (activation secondaire du SRAA) ou un mécanisme d’échappement rénal en cas d’activation du SRAA primitif qui limite la surcharge sodée (mécanisme impliquant la synthèse de prostaglandines intrarénales)(5).
Le SRAA : rappels
• La sécrétion de la rénine par les cellules à grains de rénine situées au niveau de la paroi des artérioles afférentes glomérulaires est sous la dépendance de trois stimuli :
– la pression de perfusion détectée par des mécanorécepteurs sensibles à l’étirement ;
– des récepteurs b adrénergiques présents au pôle basolatéral ;
– la quantité de chlorure de sodium délivrée aux cellules de la macula densa au niveau du tube distal.
• Cette régulation est mise en jeu en quelques dizaines de minutes en ce qui concerne la rénine libérée dans le volume circulant et qui aboutit à la libération d’aldostérone.
La demi-vie plasmatique de l’aldostérone étant brève (15 minutes), l’augmentation du taux plasmatique d’aldostérone peut être observée en 1 à 2 heures ; en revanche, l’effet rénal, c’est-à-dire la modification de l’excrétion rénale de sodium et de potassium, est plus retardé (observé classiquement à partir de la 6e heure).
D’après ce qui précède, on comprend l’intérêt de la mesure de rénine aldostérone plasmatique en position debout et couchée : l’orthostatisme stimule la sécrétion de rénine en rapport avec une baisse de la perfusion rénale, liée à la fois à une diminution de la volémie efficace et à une stimulation du système sympathique. Cette épreuve dynamique permet ainsi de sensibiliser le test chez des patients potentiellement stressés en situation basale.
Trois précautions sont cependant indispensables lors de la réalisation de cette épreuve, afin d’obtenir la bonne interprétation des résultats :
– la position couchée doit être stricte pendant 2 heures (sans oreiller de préférence) : en pratique, le patient reste en position debout habituellement pendant 30 minutes, puis se met en position allongée ;
– il ne doit pas y avoir de variations brutales du régime alimentaire dans les jours qui précèdent l’épreuve (une restriction sodée brutale aura pour effet de stimuler la sécrétion de rénine) ;
– l’éventuel traitement anti-HTA pris par le patient doit être neutre sur le SRA.
Démarche diagnostique : existe-t-il une activation du SRAA ?
La démarche logique, c’est-à-dire physiopathologique, à suivre chez un patient hypertendu ayant une hypokaliémie est de rechercher une activation du SRA permettant d’expliquer l’hypokaliémie. L’hypothèse qui est faite implicitement consiste à envisager le trouble ionique comme intégré au tableau clinique d’HTA. Il semble donc opportun au préalable, de rechercher à l’interrogatoire une cause évidente de perte de potassium, soit une origine digestive (diarrhées ou vomissements) soit rénale (classiquement prise de diurétiques) (cf. infra).
La démarche diagnostique proposée est représentée figure 2 et comporte dans tous les cas la réalisation d’un dosage plasmatique de rénine aldostérone en position debout, puis couchée.
Figure 2. Démarche physiopathologique d’une HTA associée à une hypokaliémie.
Aldostérone plasmatique élevée, rénine basse : penser à l’hyperaldostéronisme primaire
La découverte d’une aldostérone plasmatique élevée en positions debout et couchée, associée à une rénine basse est évocatrice d’un hyperaldostéronisme primaire et oriente vers un adénome de Cohn ou une hyperplasie des glandes surrénales. Un bilan complémentaire de deuxième intention est alors indiqué avec une recommandation actuelle pour une imagerie par résonance magnétique (IRM) centrée sur les surrénales. La prise en charge ultérieure justifie un avis spécialisé, sauf dans les cas les plus typiques, afin de porter ou non une indication d’exérèse d’un adénome ou une surrénalectomie unilatérale dans le cas d’une hyperplasie après dosages hormonaux étagés lors d’un cathétérisme des veines surrénales.
En cas de normalité de l’imagerie, le tableau biologique mérite d’être recontrôlé (attention au traitement non neutre !) et doit faire évoquer tout particulièrement chez le patient sub-saharien le diagnostic différentiel d’HTA à rénine basse. Les 30 cas décrits dans la littérature de glucocorticoid responsive aldosteronism (GRA), expression d’aldostérone ectopique dans la zone réticulée de la surrénale sous la dépendance de l’ACTH, du fait d’une mutation duplication du gène de l’aldostérone, ne sont à envisager que dans les cas d’antécédents familiaux d’HTA sévère du sujet jeune.
Rénine et aldostérone plasmatique élevées : penser à un hyperaldostéronisme secondaire à une sténose des artères rénales ou à une hypovolémie
La découverte d’une rénine et d’une aldostérone plasmatique élevées en positions debout et couchée caractérise l’hyperaldostéronisme secondaire (secondaire à l’augmentation de la rénine). En deuxième intention, il est classique de demander la réalisation d’un Doppler des artères rénales à la recherche d’une sténose, bien que cet examen soit généralement réalisé en première intention chez de nombreux patients hypertendus. Si l’HTA maligne est un diagnostic évident et rarement documenté au moment de l’hospitalisation, la « tumeur à rénine » est une étiologie anecdotique ; ce tableau biologique correspond, dans la majorité des cas, à un hyperaldostéronisme secondaire à une hypovolémie. Il convient alors de rechercher l’origine de la perte de sodium : digestive ou rénale(6).
En dehors des cas mentionnés précédemment retrouvés à l’interrogatoire, l’enquête doit alors se porter sur la prise d’agents pharmacologiques « non conventionnels » : les infusions à effet diurétique remises à la mode depuis une dizaine d’années avec une mention toute particulière dans notre expérience pour les queues de cerises, prêle, cassis, persil, etc.
L’origine de la perte de sodium peut être difficile à mettre en évidence en l’absence d’interrogatoire fiable (acétazolamide pour glaucome chronique non mentionné, etc.) et doit être étayée par la réalisation de ionogrammes urinaires sur 24 heures, éventuellement répétés lors de plusieurs consultations : en effet, la présence d’une natriurèse basse suggère une contraction des volumes extracellulaires, mais peut également indiquer un régime désodé strict. Seule la répétition de cet examen permettra d’évoquer ce diagnostic en cas de modification importante de la natriurèse d’une fois sur l’autre.
Évaluation des apports en chlorure de sodium (NaCl) quotidiens exprimés en g/j = Na+ urinaire (mmol/j)/17.
Critères en faveur d’une fuite rénale de potassium (en cas d’hypokaliémie) : K+ urinaire > 20-30 mmol/j ou > 0,5 mmol/kg/j.
Rénine et aldostérone plasmatique basses : penser au pseudo-hyperaldostéronisme hormonal, pharmacologique ou génétique
• La découverte inattendue d’une rénine et d’une aldostérone plasmatique basses en position debout et couchée chez un patient hypertendu et hypokaliémique caractérise le pseudo-hyperaldostéronisme, i.e. tableau biologique suggérant un hyperaldostéronisme. Dans cette situation, où il existe une réabsorption exagérée de sodium couplée à une excrétion de potassium (d’où l’hypokaliémie) responsable d’une hypervolémie avec inhibition du SRA, il est nécessaire de rechercher un possible effet minéralocorticoïde lié à des stéroïdes endogènes ou exogènes et notamment le syndrome de Cushing et les très rares blocs enzymatiques sur la voie du cortisol. Le dosage du cortisol libre urinaire sur 24 heures peut alors être proposé en « débrouillage », mais un avis endocrinologique spécialisé est nécessaire, le diagnostic reposant sur un certain nombre de tests spécialisés (cortisol salivaire, test de freination à la dexaméthasone, ACTH plasmatique, etc.). L’interrogatoire et l’examen clinique rechercheront les signes d’une imprégnation cortisonique, notamment une prise de poids et des vergetures pourpres…
Deux autres diagnostics méritent cependant d’être évoqués : la classique intoxication au réglisse et le syndrome de Liddle (figure 3).
Figure 3. Représentation schématique d’une cellule principale du canal collecteur principal : illustration d’une intoxication au réglisse. L’effet inhibiteur du réglisse sur l’enzyme 11-bHSD est responsable d’une accumulation dans la cellule de cortisol qui se fixe au MR, favorisant la réabsorption de Na+ et la sécrétion de K+. MR : récepteur minéralocorticoïde, 11-bHSD : 11-bhydroxystéroïdo- deshydrogénase (type 2) ; ENaC : canal sodium apical (amiloride-sensible) ; ROMK : canal potassium.
• Un des principes actifs du réglisse (l’acide glycyrrhizique) a la propriété d’inhiber la 11-b hydroxystéroïdo-deshydrogénase de type II (11-b OH DSD), enzyme présente dans le cytoplasme des cellules principales du CC et dont la fonction est de transformer le cortisol en cortisone. En situation normale, le cortisol, ligand potentiel du récepteur minéralocorticoïde, est transformé en cortisone qui a perdu cette propriété. L’inhibition de 11-b OH DSD mime le tableau rénal de l’hypercorticisme, mais avec un cortisol plasmatique et urinaire normal. Il est à noter que cet effet pharmacologique persiste quelques semaines à l’arrêt de l’intoxication.
• Le syndrome de Liddle est une maladie monogénique autosomale récessive rare (prévalence < 1/1000 000) qui est à évoquer chez un patient ayant un pseudo-hyperaldostéronisme et des antécédents familiaux d’HTA. Les mutations portent généralement sur une sous-unité du canal sodium apical amiloride-sensible (ENaC) qui reste ainsi en position « ouverte » et favorise une réabsorption non régulée de Na+. En cas de suspicion, la recherche génétique de la mutation est actuellement proposée.
Rénine et aldostérone plasmatique normales : le patient est euvolémique
La normalité des dosages plasmatiques est une situation fréquemment rencontrée chez les patients ayant une HTA primitive, mais rarement rencontrée lorsque s’y ajoute une hypokaliémie. En cas d’hypokaliémie persistante et non expliquée, un nouveau dosage est à envisager après avoir recherché à l’interrogatoire des antécédents particuliers ou la prise de traitements non neutres pour le SRAA (notamment la prise de bêtabloquants en association avec des diurétiques…). Une hypomagnésémie (dans un laboratoire spécialisé), associée ou non à une dyscalcémie, doit alors être recherchée. Un traitement d’épreuve par magnésium en cas de doute peut servir de test thérapeutique. Les hypokaliémies de transfert ne sont pas à évoquer si l’hypokaliémie est constante.
En pratique
La démarche diagnostique proposée ici insiste sur le fait qu’une HTA associée à une hypokaliémie est la signature, dans la majorité des cas, d’une stimulation du SRA.
Cet arbre diagnostique qui s’appuie sur le dosage plasmatique debout/couché de la rénine et de l’aldostérone et du ionogramme des urines de 24 heures permet non seulement de porter parfois un diagnostic étiologique d’une HTA secondaire justifiant un traitement spécifique chirurgical ou médical, mais également d’identifier, chez des patients ayant une HTA « idiopathique », la cause de l’hypokaliémie souvent d’origine rénale et iatrogène, et de pointer les anomalies du bilan du sodium qui expliquent souvent des HTA mal équilibrées.
En effet, il est nécessaire d’expliquer au patient la nécessité d’un régime « pauvre en sel » : il ne s’agit pas tant de diminuer le volume circulant que d’éviter les variations de la volémie induite par des modifications brutales du régime en sel (apports variables d’un jour à l’autre et/ou prise de diurétiques discontinue).
Au quotidien
Une hypokaliémie chez un patient non hypertendu ayant un hyperaldostéronisme secondaire nécessite, pour être corrigée, un apport en sodium (en plus de potassium) afin d’interrompre le processus d’excrétion de K+.
Chez un patient hypertendu, l’existence d’une hypokaliémie justifie une appréciation du SRAA et, selon les cas, un traitement symptomatique visant à inhiber l’action tubulaire de l’aldostérone (spironolactone, éplérénone ou amiloride), à traiter l’étiologie si possible ; dans certaines situations rares, la répétition des bilans urinaires de 24 heures pourra inciter à proposer un élargissement du régime en sodium.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :