Cardiomyopathies
Publié le 15 déc 2019Lecture 7 min
Un flux diastolique bien particulier
Alberto TIRITILLI et coll.*, Groupe Hospitalier du Sud de l’Oise - Site de Creil, service de cardiologie*, Creil
La cardiomyopathie hypertrophique (CMH) avec obstruction diastolique est connue depuis 1988. Elle a été décrite par Zoghbi chez 3 patients avec anévrisme apical du ventricule gauche(1). Ultérieurement grâce au travail de Nakamura portant sur 20 patients, il déduisit que seuls les patients avec CMH et anévrisme apical étaient capables de développer ce flux d’obstruction diastolique. Dans sa série la vitesse maximale au Doppler pouvait aller de 1 à 3,5 m/s et il remarqua que la durée moyenne occupait 60 % de la diastole, ceci laissant à penser que le remplissage de l’anévrisme ne pouvait se faire qu’en fin de diastole. La présence d’un flux diastolique au Doppler peut être considérée comme un signe indirect et faire rechercher un anévrisme apical(2).
D'après les travaux de Maron, il existerait un anévrisme apical chez 2 % des patients porteurs de CMH, même si le mécanisme reste indéterminé. L’échocardiographie permet le diagnostic dans environ 60 % des cas, méconnaissant les anévrismes de petite taille. En revanche, l’IRM permet de faire le diagnostic dans tous les cas. Ces anévrismes apicaux correspondent dans 2/3 des cas à une CMH avec obstruction médioventriculaire du ventricule gauche et dans 1/3 des cas toujours selon Maron à une CMH apicale. De plus, une obstruction systolique semble être présente dans 36 % des cas(3). Tout dernièrement, un travail a été publié, les auteurs ont essayé de clarifier l’évolution clinique et pronostique chez 1 940 patients dont 94 (4,8 %) avec CMH et anévrisme apical(4).
Nous décrirons un cas clinique de CMH à flux diastolique et profiterons de cette occasion pour faire un point sur cette pathologie qui reste relativement rare.
Observation
• Madame Christiane L., âgée de 74 ans, a été hospitalisée pour syndrome coronarien aigu. L’anamnèse met en évidence la présence de douleurs d’allure coronaire depuis quelques années et la patiente avait bénéficié en juillet 2012 d’une coronarographie qui était normale. Elle consulte son cardiologue traitant en 2014 pour gêne thoracique localisée. Reprenant l’interrogatoire, on s’aperçoit que depuis cinq ans elle présente des gênes épigastriques qui irradient en rétrosternal avec sensation de malaise sans perte de connaissance ni autres manifestations neurovégétatives. Ces symptômes étaient peu fréquents, mais se sont produits à trois reprises dans les 48 heures qui ont précédé son admission dans un hôpital régional. L’ECG réalisé mettait en évidence un rythme sinusal sans trouble du rythme ou de la conduction et un discret sus-décalage en inférolatéral. L’échocardiographie montre une akinésie de la pointe et des segments adjacents. Ainsi, la patiente a été adressée au service de coronarographie. L’opacification coronaire montre un réseau coronaire normal avec dominance droite. La ventriculographie pouvait être compatible avec un Takotsubo (figure 1).
Figure 1. La coronarographie montre un réseau coronaire indemne de lésions à dominance droite et la ventriculographie semble compatible avec un Takotsubo.
• Sur le plan biologique, numération globulaire normale, hémoglobine à 15 x 10/l, ionogramme correct avec créatinine à 97,5 micromol/l. Par ailleurs, la troponine ultrasensible était normale, dosée à 13,28 ng/l et le NT-proBNP discrètement élevé à 953,80 pg/l.
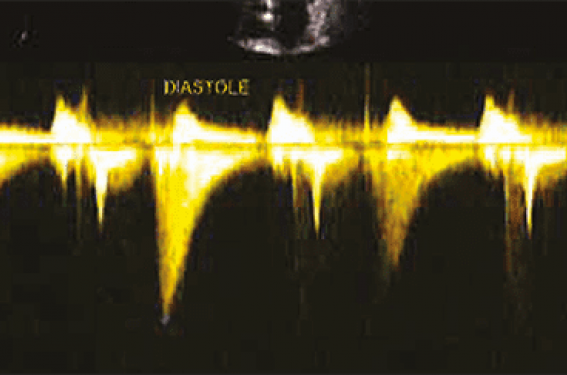
• Le bilan échocardiographie- Doppler montre une aorte initiale non dilatée, trois sigmoïdes épaissies et un Doppler normal. Le ventricule gauche présente une hypertrophie du SIV segment médio-apical, débordant sur la paroi antérieure, latérale et postérieure. La FEVG est conservée à 60 % sans trouble de la cinétique et notamment pas d’ectasie apicale. On observe une discrète diminution du strain longitudinal global à -14,2 %. La valve mitrale est remaniée et le Doppler est normal. Par ailleurs, la VCI était normale, les cavités droites aussi et il n’y avait pas d’HTAP. Le Doppler continu et pulsé met en évidence un flux médio-ventriculaire diastolique différent du classique « lame de sabre » systolique observé dans les CMH. Dans notre cas le flux est inversé, il occupe toute la diastole 529,41 ms, avec une vitesse maximale de 3,26 m/s et un gradient max de 42,50 mmHg (figure 2).
Figure 2. Le Doppler continu montre un flux diastolique, à noter son début après l’onde T télé systolique sur l’ECG. Il occupe toute la diastole 529,41 ms, avec une vitesse maximale de 3,26 m/s et un gradient max de 42,50 mmHg. De plus, on remarque une discrète diminution du strain longitudinal global de -14,2 %.
• Une IRM a été effectuée, celleci relate une hypertrophie localisée dans le territoire antérosepto-apical de 20 mm et aussi toute la paroi basale. Il existe un minime oedème myocardique au sein des segments apicaux évoquant une souffrance myocardique probablement liée à l’hypertrophie. Si la séquence de perfusion est normale, celle du rehaussement tardif montre de petites prises de contraste intramurales au niveau des segments susmentionnés, ceci aussi très en faveur de souffrance myocardique liée à l’hypertrophie. De plus, elle infirme le diagnostic de Takotsubo et celui de myocardite (figure 3).
Figure 3. L’IRM montre une hypertrophie de 20 mm dans le territoire antéro-septo-basal. Pas d’obstacle éjectionnel. Elle infirme le diagnostic de Takotsubo et de myocardite.
Discussion
La CMH est une cardiopathie génétique hétérogène cliniquement et morphologiquement. Le pronostic a été considéré longtemps comme défavorable, lié d’une part, à une aggravation progressive sur le plan hémodynamique, et d’autre part, pour le risque rythmique qu’elle entraîne, pouvant être à l’origine de mortalité prématurée. Le diagnostic est retenu devant une épaisseur pariétale VG supérieure ou égale à 15 mm. Pour les épaisseurs moindres (13 mm), le diagnostic est soutenu par la présence d’autres éléments, histoire familiale, symptomatologie non cardiaque, anomalies électriques ou biologiques, imagerie scanner ou IRM. Bien entendu, le diagnostic sera retenu après avoir éliminé les CMH vieillies avec dysfonction VG, le cœur d’athlète, l’HTA et le RAC serré à différencier également de l’hypertrophie basale isolée du sujet âgé.
La CMH est le plus souvent d’origine génétique. La transmission se fait le plus habituellement sur un mode autosomique dominant. Dans environ 50 % des cas, elle est liée à une mutation hétérozygote d’un gène du sarcomère : chaîne lourde de la myosine, protéine C cardiaque, troponine T. Les CMH non sarcomériques, 20 % sont liées aux maladies métaboliques, neuro-musculaires, à l’amylose, aux syndromes malformatifs. Dans 30 % des cas l’étiologie reste inconnue.
L’évolution est très variable en fonction de l’étiologie et des patients. Le pronostic est lié à l’évolution vers l’insuffisance cardiaque et à la mort subite.
La prise en charge va dépendre de la symptomatologie mais surtout de la prévention de la mort subite
• Plusieurs situations :
Chez le patient symptomatique la prise en charge repose sur l’évaluation de l’obstruction intra-VG. L’échocardiographie Doppler est l’examen de référence.
• S’il n’y a pas d’obstruction, patient asymptomatique, aucun traitement n’est proposé, mais une surveillance échographique annuelle.
• Si le patient présente un gradient de repos ou après manoeuvres classiques un gradient > 50 mmHg, un traitement s’impose. Celui-ci fait appel aux bêtabloquants ou inhibiteurs calciques en cas d’intolérance. Si le patient reste toujours symptomatique ou en cas d’inefficacité médicamenteuse, la myectomie va être discutée, celle-ci peut être réalisée par alcoolisation septale ou chirurgicale, la décision sera prise en milieu spécialisé en fonction de la forme et la spécificité du patient.
• Si l’échographie ne montre pas d’obstruction chez un patient symptomatique, une échocardiographie d’effort est pré - conisée. Si le gradient est > 50 mmHg le traitement semble licite, bien entendu celui-ci sera adapté en fonction de la situation clinique du patient.
• La prévention secondaire de la mort subite
Elle s’adresse aux patients ayant présenté un arrêt cardiaque récupéré après trouble du rythme grave (TV ou FV). En cas de TV soutenue avec syncope et retentissement hémodynamique et si l’espérance de vie est supérieure à 1 an le défibrillateur automatique implantable (DAI) est indiqué.
L’implantation d’un défibrillateur en prévention primaire va être discutée dans des centres d’experts en rappelant les bénéfices et les risques du DAI.
Cette forme à flux diastolique est rare
Ceci expliquerait aussi le fait que le diagnostic chez notre patiente a été longtemps ignoré.
La symptomatologie clinique chez Mme Christiane L. a été pendant longtemps assez atypique et c’est seulement la recrudescence accrue de douleurs thoraciques qui l’ont conduite d’abord à la coronarographie qui est normale, puis à l’échocardiographie qui a permis de réorienter le diagnostic initial.
Nous pensons que même ces formes dites « à gradient diastolique » doivent être considérées comme cliniquement périlleuses, d’une part, pour leur transformation bruyante, douleur thoracique comme dans notre observation, d’autre part, pour les troubles rythmiques qu’elles peuvent entraîner.
Dans notre observation, la surveillance en USIC 24 heures a permis de rassurer la patiente qui est restée totalement asymptomatique ; de plus, la télémétrie n’a pas mis en évidence de trouble du rythme. L’évolution ultérieure a été bonne et la patiente a quitté l’hôpital avec un traitement pharmacologique adapté, elle est revue en consultation régulièrement.
Il semble nécessaire de contrôler ces patients et ne pas hésiter à faire des holters des 24 heures, voire plus longtemps à la recherche de trouble du rythme. La surveillance clinique bisannuelle semble également souhaitable.
Les premières publications ont insisté sur la présence d’un anévrisme apical. Dans notre observation, aussi bien l’échocardiographie que l’IRM n’ont pas montré d’ectasie apicale. Nous pensons ainsi qu’une CMH à flux diastolique ne nécessite pas forcément d’association anévrismale.
En pratique
Nous voudrions insister sur le caractère protéiforme de cette CMH. La découverte tardive due à sa rareté, la symptomatologie clinique atypique, l’optimisation du traitement pharmacologique.
Il faut rappeler que ce sont des patients à haut risque nécessitant une surveillance clinique et rythmologique accrue.
L’identification de ce groupe de patients permettra de mieux stratifier le risque, de choisir plus précocement un traitement adéquat et potentiellement de prévenir les complications.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







