Publié le 01 mar 2018Lecture 6 min
AOD : toujours de nouvelles perspectives
Michèle DEKER, Paris

JESFC
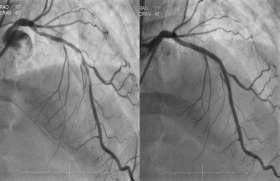
Les anticoagulants oraux directs (AOD) ont acquis une place de choix dans le traitement préventif des événements ischémiques chez les patients en fibrillation atriale (FA) et des récidives d’événements thromboemboliques veineux (ETEV), et ce quel que soit l’âge. Leur champ d’application s’étend aujourd’hui aux situations complexes, telle celle des patients FA en post-syndrome coronarien aigu (SCA) qui représentent environ 5 % des patients traités pour un SCA.
Perspectives après un SCA
Il existe de nombreuses façons de bloquer l’activation plaquettaire, dont l’agoniste le plus puissant est la thrombine. Après un SCA, les niveaux de thrombine restent élevés, faisant de la thrombine l’équivalent d’un facteur de risque chronique. Or, les thiénopyridines ne bloquent pas l’activation plaquettaire par la thrombine.
L’étude ATLAS ACS 2-TIMI 51 a évalué la posologie du rivaroxaban en post-SCA et montré qu’une dose très faible de 2,5 mg x 2/j est la plus efficace pour diminuer la mortalité vasculaire et la mortalité toutes causes. Ces résultats ont été validés avec une réduction de 31 % des thromboses de stent en associant cette faible dose de rivaroxaban à une double antiagrégation plaquettaire vs placebo (p = 0,008). À la dose de 2,5 mg x 2/j, le rivaroxaban permet de bloquer l’activation plaquettaire tout en minimisant le risque hémorragique (0,04 % d’hémorragies fatales vs 0,4 % à la dose de 10 mg). Comparativement au placebo, la bithérapie antiplaquettaire réduit de 75 % le risque d’AVC chez les patients en FA. En ajoutant le rivaroxaban à une thiénopyridine, on observe un effet synergique sur l’agrégation plaquettaire.
L’étude PIONEER AF-PCI a montré une réduction de près de 10 % du risque hémorragique (en particulier les hémorragies mortelles) dans les deux bras rivaroxaban 2,5 mg x 2/j ou 15 mg/j vs AVK, avec néanmoins un surcroît d’événements ischémiques à la dose de 2,5 mg x 2/j, mais une réduction significative des réhospitalisations pour événements cardiovasculaires et hémorragiques.
Les résultats combinés de PIONEER avec le rivaroxaban et de ReDUCE PCI avec le dabigatran permettent de conclure à la non-infériorité de l’association AOD à dose réduite + P2Y12 vs AVK + P2Y12 + aspirine. La mise à jour des recommandations ESC stipule que la plus faible dose d’AOD doit être utilisée encombinaison avec l’aspirine et/ou le clopidogrel, en prévention des événements ischémiques chez les patients en FA.
FA : un reflet des pratiques françaises
Le traitement anticoagulant est d’autant plus bénéfique que le patient est âgé en raison du risque d’AVC ischémique. Toutefois, le risque hémorragique des AVK est particulièrement élevé chez les octogénaires (10-12 %/an).
Un registre prospectif multicentrique SAFiR (bleeding risk in elderly subjects aged more than 80 years in atrial fibrillation treated by rivaroxaban), a été mis en place depuis 2015 en France en recrutant essentiellement dans des centres gériatriques des patients nouvellement traités par rivaroxaban pour FA non valvulaire. Les résultats ont été comparés à ceux d’une cohorte similaire de 924 patients gériatriques > 80 ans traités par AVK suivie prospectivement de 2011 à 2015. Le principal critère d’évaluation de ces deux registres est la survenue d’une hémorragie majeure.
Les résultats disponibles concernent 855 patients, âge moyen 86 ans (23 % > 90 ans), à haut risque (30,9 % AVC, 36 % insuffisance cardiaque, 19,8 % diabète, CHA2DS2VASc 4,82, HAS BLED 2,35), avec de nombreuses comorbidités (par ordre de fréquence : HTA, dénutrition, anémie, démence, etc.), d’où un score de Charlson de 6,7. La majorité (90 %) de ces patients sont ambulatoires, la moitié vivent seuls. L’évaluation cognitive montre un MMSE à 21,4/30 en moyenne et un score d’autonomie ADL à 4,5/6. Seulement 13,3 % prennent des antiplaquettaires. La moitié des patients ont une ClCr < 50 ml/min.
Il s’agit pour 41 % de FA paroxystique et 59 % de FA persistante/permanente, asymptomatique ou pauci-symptomatique dans la très grande majorité des cas. Un antécédent de saignement était retrouvé chez 17 % des patients. Le rivaroxaban a été prescrit dans 65 % en initiation de traitement, 35 % en switch, à la dose de 15 mg/j dans 66 % des cas.
Comparativement à cette cohorte, celle des patients traités par AVK diffère par l’importance des comorbidités, plutôt non cardiovasculaires.
Les résultats de la cohorte SAFiR montrent sur 855 patients : 6,9 % d’hémorragies majeures, 0,8 % fatales, 1,6 % intracérébrales, 2,6 % gastro-intestinales ; 8 AVC et 155 décès sont survenus. Comparativement à la cohorte AVK, moins d’hémorragies majeures (HRa 0,59, p = 0,004), d’hémorragies intracérébrales et d’AVC ischémiques sont survenues dans la cohorte traitée par rivaroxaban ; la mortalité totale est équivalente dans les deux groupes.
Personnaliser le traitement selon la fonction rénale
L’insuffisance rénale est fréquente chez les patients en FA. Pour des DFG entre 30 et 60 ml/min et en l’absence de poids extrêmes, la formule de Cockroft est convenable. L’ajustement de dose des AOD concerne les clairances de 30 à 60 ml/min. L’efficacité des AVK est amoindrie par un net surrisque hémorragique et, en cas de néphrotoxicité, un risque d’insuffisance rénale chronique séquellaire.
Les AOD sont au moins aussi efficaces et bien tolérés que les AVK. Tous les AOD étant majoritairement éliminés par voie rénale, il est nécessaire d’adapter la posologie, en se conformant aux critères de chaque molécule dans les RCP. L’adaptation posologique du rivaroxaban est simplement basée sur la fonction rénale et ses résultats sont particulièrement robustes chez les patients en insuffisance rénale.
En pratique, les AOD ont tendance à être sous-dosés, sans doute par peur des hémorragies, ce qui se traduit par une augmentation des événements ischémiques. Une étude rétrospective (Yao X et al. J Am Coll Cardiol 2017) suggère que les AOD, en raison de leur probable effet antiinflammatoire, auraient une meilleure tolérance rénale que les AVK, qui sont responsables de dépôts vasculaires de calcium.
ETEV : prévention à long terme des récidives
Le traitement à long terme ETEV doit privilégier les AOD en raison de leur profil de sécurité d’emploi. La stratégie décisionnelle implique d’évaluer au cas par cas le risque de récidive sans anticoagulant et son impact en termes de pronostic, le risque hémorragique du traitement anticoagulant, les alternatives thérapeutiques, tout en prenant en compte les préférences du patient. Deux types de facteurs de risque majeurs sont reconnus : des facteurs transitoires (chirurgie, fracture de jambe, immobilisation, traitements hormonaux) qui, une fois disparus, n’augmentent pas le risque de récidive ; des facteurs permanents (cancer, syndrome des antiphospholipides, maladies inflammatoires chroniques, cœur pulmonaire chronique postembolique) qui impliquent événement non provoqué ne relève d’aucun de ces facteurs de risque majeur.
Parallèlement il existe des facteurs de risque mineurs persistants qui modulent le risque et incitent à prolonger le traitement : thrombophilie mineure, antécédents familiaux d’ETEV, sexe masculin, embolie pulmonaire plus que TVP, obésité, impotence, insuffisance cardiaque et rénale. Inversement, d’autres facteurs incitent à ne pas prolonger le traitement : femme £ 50 ans, risque hémorragique. D’autres facteurs sont potentiellement liés au risque de récidive : séquelles anatomiques, anomalies mineures du bilan thrombophilique, Ddimères, âge et filtre cave. Isolément, aucun de ces facteurs ne justifie la poursuite du traitement anticoagulant.
Les recommandations sont claires : en cas de récidive d’ETEV non provoqué, traitement anticoagulant à vie ; en cas de 1er ETEV provoqué, traitement de 3 mois. La difficulté réside dans les cas de 1er ETEV non provoqué ou de 1er ETEV favorisé par des facteurs de risque mineurs mais persistants. Parmi ces patients, 70 % nécessitent un traitement de 6 mois, 30 % un traitement à vie. Le traitement anticoagulant ne peut s’envisager que si le taux annuel de récidive est supérieur au taux de mortalité par hémorragie. À l’échéance de 2 ans, la balance bénéfice/risque est défaveur du maintien sous AVK. Plusieurs scores de risque ont été développés, le mieux validé étant HERDOO2, dont le principal intérêt est d’identifier les patients à bas risque de récidive. Parallèlement doit être évalué le risque hémorragique.
Les AOD permettent d’améliorer la tolérance. Dans l’étude EINSTEIN-Extension, à pleine dose pendant 6-12 mois, le rivaroxaban permet de diminuer les récidives sans surcroit d’hémorragies majeures mais avec davantage d’hémorragies cliniquement significatives. Dans EINSTEIN-CHOICE, le rivaroxaban 10 mg/j réduit les récidives d’ETEV fatales ou non, davantage que l’aspirine et presque autant que le rivaroxaban à pleine dose, quels que soient le profil de risque du patient et la durée du traitement anticoagulant initial, et sans surcroit de risque hémorragique. Tous les patients tirent bénéfice de cette stratégie de prévention des récidives, à l’exception des patients ayant présenté un ETEV dans un contexte de facteur favorisant transitoire.
Il est donc légitime de proposer un traitement de longue durée par AOD à demi-dose en présence d’un ETEV non provoqué et/ou en présence de facteurs de risque persistants. La durée du traitement peut être modulée (3-6 mois si risque hémorragique élevé). La non-infériorité des AOD vis-à-vis des AVK reste à démontrer chez les patients à très haut risque de récidive (thrombophilie majeure, récidives non provoquées).
D’après un symposium avec le soutien de Bayeret la collaboration de C.M. Gibson, O. Hanon, G. Deray et N. Meneveau
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :