Vasculaire
Publié le 10 mai 2015Lecture 17 min
Imagerie des dissections artérielles cervicales
G. DEKLUNDER, C. GAUTIER, F.-X. HIMPENS, Explorations fonctionnelles cardiovasculaires, Hôpital Cardiologique, CHU de Lille
La dissection spontanée des artères cervicales est une cause fréquente d’accident vasculaire ischémique chez l’adulte jeune. Un diagnostic adéquat et précoce est indispensable à une prise en charge thérapeutique appropriée susceptible de réduire significativement le risque ischémique et les séquelles neurologiques. Les techniques d’imagerie non invasive, imagerie par ultrasons, imagerie par résonance magnétique, angiographie par résonance magnétique et angioscanner permettent actuellement le diagnostic de cette pathologie dans la majorité des cas. Ils assurent aussi la surveillance de l’évolution temporelle des lésions.
Généralités
La dissection spontanée des artères cervicales représente la première cause d’accident vasculaire ischémique (20 %) chez l’adulte de moins de 45 ans dans les pays occidentaux.
L’incidence annuelle est estimée à près de 3 pour 100 000 habitants mais elle est en réalité probablement plus élevée car il existe de nombreuses formes pauci symptomatiques ou très rapidement régressives qui échappent au diagnostic.
La dissection résulte d’un clivage de la paroi artérielle par un hématome intra mural spontané ou secondaire à une brèche intimale. Dans ce dernier cas, le sang pénètre la paroi au niveau de la brèche et la dissection s’étend alors selon la même direction que le flux sanguin, sur une distance variable. L’hématome intra mural, quel que soit son mode de constitution, comprime la lumière artérielle et entraîne une augmentation du diamètre externe du vaisseau. La dissection peut être soit sous intimale et responsable d’une sténose ou d’une occlusion artérielle selon l’importance de l’hématome, soit sous-adventicielle, entrainant alors la formation d’un anévrysme.
Localisation
La localisation carotidienne est environ trois fois plus fréquente que la localisation vertébrale. Les dissections multiples sont loin d’être rares puisqu’on les observe dans près de 30 % des cas. Le point de départ des dissections est en général localisé dans une région mobile, plus vulnérable, comme le segment post bulbaire de l’artère carotide interne (ACI), les boucles, les jonctions entre portions fixes et portions mobiles des artères vertébrales (AV) (près de 75 % des dissections vertébrales se produisent au niveau de la zone d’entrée dans le canal rachidien ou de la zone de sortie du canal en V3).
La dissection de l’artère carotide interne extra crânienne débute toujours en aval du bulbe carotidien et s’étend en hauteur jusqu’à la pénétration intracrânienne du vaisseau où l’artère reprend un calibre nor- mal. Plus rarement, elle peut aussi se limiter à un court segment artériel en regard de C1-C2 ou s’étendre au segment intra pétreux et intra caverneux de l’artère carotide interne(1-3).
Pathogénie
L’étiopathogénie de la dissection des artères cervicales fait toujours débat et le plus souvent aucune cause n’est retrouvée d’où le terme de dissection spontanée. Un traumatisme est parfois observé (15 % des cas au maximum) dans les antécédents récents, soit dans jours ou heures précédant les premiers symptômes. S’il est sévère, on parle alors de dissection traumatique et non plus spontanée mais, en pratique, il s’agit beaucoup plus souvent d’un traumatisme mineur (efforts de vomissement, activité physique sollicitant le cou, manipulation vertébrale, toux ou éternuement liés à une infection récente des voies aériennes supérieures). Ces microtraumatismes sont en règle générale parfaitement tolérés et il est donc suggéré qu’ils n’entraînent de dissection dite « spontanée » que chez des individus porteurs d’une prédisposition génétique, prédisposition qui semble multifactorielle. L’hypothèse est séduisante et repose sur un faisceau d’arguments mais elle n’est cependant toujours pas démontrée(4-6).
Symptomatologie
L’importance de l’hématome intra mural et son extension dictent en bonne partie la symptomatologie :
Les dissections spontanées de l’ACI qui entrainent une sténose sévère ou une occlusion sont à risque élevé d’ischémie, embolique ou hémodynamique, dans le territoire cérébral correspondant (50 % à 80 % des patients selon les auteurs). Un tableau d’ischémie cérébrale transitoire ou constitué peut ainsi exister d’emblée ou apparaître dans un second temps, après un épisode de céphalées et cervicalgies.
Les dissections sans retentissement sur la lumière vasculaire s’expriment plus volontiers par des signes locaux (douleurs, signes de compression des dernières paires crâniennes observés dans environ 5 % des cas). Le diagnostic de dissection de l’ACI doit donc être évoqué devant l’apparition de signes cliniques à type de céphalées, de cervicalgies, de syndrome de Claude Bernard Horner (ptosis, myosis, rétrécissement de la fente palpébrale). La présence d’acouphènes pulsatiles est également possible.
Le tableau de dissection de l’artère vertébrale est souvent moins typique avec une douleur cervicale parfois isolée, qui précède ou s’associe à un déficit neurologique comme un syndrome de Wallenberg.
La symptomatologie clinique peut donc être trompeuse voire même absente puisque, quel que soit le territoire, la dissection peut aussi être silencieuse. Il est dès lors facile de comprendre pourquoi les progrès de l’imagerie, à laquelle on a maintenant recours fréquemment en présence de signes fonctionnels mineurs, permettent d’établir beaucoup plus souvent qu’au préalable le diagnostic de dissection. Évoqué cliniquement, ce diagnostic sera donc toujours confirmé par la réalisation d’une imagerie non invasive associant de préférence deux techniques, écho-Doppler et IRM ou écho-Doppler et angioscanner selon les possibilités du plateau technique. Dans certains cas, seule l’évolution dans le temps des images permettra de rattacher avec certitude à une dissection les anomalies artérielles observées en imagerie. L’évolutivité relativement rapide de ces anomalies constitue un argument diagnostique important et justifie un suivi rapproché en cas de doute(7,8).
Pronostic
L’évolution de la dissection cervicale est souvent rapidement favorable sans traitement invasif. La résolution complète et précoce de la dissection est observée dans plus de 50 % des cas avant 6 mois (80 à 90 % des formes sténosantes, 50 % seulement des formes occlusives)(9). Dans de très rares cas, il est possible d’observer des recanalisations tardives, après 1 an(10). La régression des anévrysmes semble rare, même à long terme(11).
Le risque de récidive de la dissection dans le territoire initialement atteint est faible, sauf dans les cas où elle est associée à une dystrophie du tissu élastique.
Il n’existe pas de recommandation pour la prise en charge thérapeutique des dissections. Cependant, pour prévenir les accidents ischémiques, la plupart des équipes prescrivent un traitement anticoagulant dès le diagnostic établi. Au bout de trois mois, le relais est pris par un traitement antiagrégant plaquettaire. Au bout de six mois le traitement médical est arrêté sauf quand l’imagerie met en évidence une sténose ou un anévrysme résiduels, même si le risque de complications cliniques est faible(11,12).
Échographie Doppler
Diagnostic positif(7,13-16)
Il est indispensable de réaliser le premier examen écho-Doppler le plus rapidement possible après l’installation des signes cliniques en raison de l’évolutivité souvent rapide des lésions. Le contexte clinique, la localisation lésionnelle et les particularités sémiologiques en échographie vont le plus souvent permettre le diagnostic positif de dissection.
L’examen débute de façon classique avec une sonde linéaire de haute fréquence. Si l’examen est normal ou s’il montre des signes hémodynamiques en faveur d’un obstacle non visualisé, en particulier lorsque la bifurcation est haut située, le recours à une sonde microconvexe et de plus basse fréquence s’impose puisqu’on peut alors accéder au segment sous pétreux de l’artère carotide interne ou au segment V3 de l’artère vertébrale, zones difficilement visualisées habituellement. Une sonde phased-array de basse fréquence est bien sûr aussi utilisée, lorsque le diagnostic de dissection est posé, pour évaluer le retentissement d’aval en écho-Doppler transcrânien (EDTC). Comme toujours, l’exploration doit être exhaustive et concerner, en mode 2D comme en modes Doppler, les quatre axes à destinée encéphalique. Les caractéristiques morphologiques et hémodynamiques doivent être étudiées et décrites dans le compte-rendu. L’optimisation des réglages est fondamentale, en mode 2D pour permettre la visualisation de l’hématome de paroi et en mode Doppler pour permettre la détection du chenal circulant en particulier lorsque le débit n’est plus maintenu dans les sténoses très sévères.
Les signes morphologiques sont spécifiques
En cas de dissection carotidienne, l’hématome de paroi (figures 1 et 2) est situé sur la portion haute, sus bulbaire de l’artère carotide interne. Le bulbe est toujours indemne. L’hématome s’étend en général depuis la région rétro-stylienne jusqu’en sous pétreux. L’examen est d’autant plus aisé que la bifurcation carotide du patient est bas située et dans ce cas l’hématome de paroi peut être suivi sur plusieurs centimètres. L’image 2D caractéristique de la dissection est celle d’une paroi épaissie hypoéchogène, ou plus rarement isoéchogène, l’épaississement étant d’aspect homogène. Il existe un élargissement du calibre artériel en regard et une réduction souvent importante du chenal circulant. La présence d’un thrombus flottant situé en amont est possible, de même que celle d’un lambeau intimal visible dans la lumière ou d’un double chenal circulant mais ces aspects sont rares en pratique.
Figure 1. Dissection de l’ACI. Structure pariétale hypoéchogène, homogène et sus- bulbaire, caractéristique d’un hématome de paroi. L’anomalie est bien visible parce qu’elle est moulée par l’imagerie de flux. DR
Figure 2. Aspect proche de celui décrit figure 1, mais l’anomalie pariétale est ici anéchogène et détectable uniquement parce qu’elle est moulée par l’imagerie de flux. DR
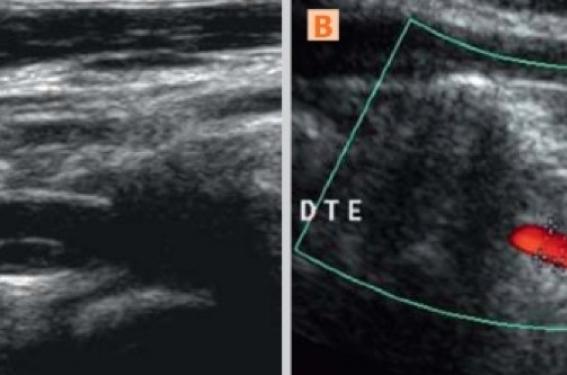
En cas de dissection vertébrale, l’hématome de paroi (figure 3) est souvent présent à la jonction V1 distal-V2 et en V2, ou à la sortie du canal rachidien en V3. Sur des plans de coupe étagés au long de la zone disséquée, la position de l’hématome sur la circonférence du vaisseau est souvent variable en raison du trajet fréquemment hélicoïdal de la dissection. La présence d’un double chenal est également rare dans la dissection vertébrale (figure 4).
Figure 3. Deux exemples de dissection vertébrale dans le segment V2 proximal. Calibre artériel augmenté et chenal circulant excentré dans les 2 cas. A : hématome de paroi anéchogène, seule l’interface entre l’hématome et la lumière est visible ; B : aspect isoéchogène de l’hématome de paroi. DR
Figure 4. Dissection vertébrale. Aspect rare : flap intimal visible dans la lumière (A), présence de 2 chenaux circulants [vrai chenal (B), faux chenal à circulation plus lente (C)]. Aspect de double chenal retrouvé en ARM (D). DR
Que la dissection concerne l’axe carotidien ou vertébral, l’élargissement du calibre peut être important et entraîner un aspect anévrysmal (figure 5).
L’absence de lésions athéromateuses, les localisations parfois multiples et l’évolution rapidement régressive viennent conforter le diagnostic.
Figure 5. Deux exemples de dissection avec développement d’un anévrysme sur une artère carotide interne sus-bulbaire (A) et sur une artère vertébrale à la jonction V1/V2 (B). DR
Les signes hémodynamiques sont importants mais non spécifiques
En raison de la constitution rapide de l’obstacle, les signes hémodynamiques sont en général francs et on observe un profil de vitesses de type « haute résistance » unilatéral sur l’artère carotide commune ou sur l’artère vertébrale proximale [indice de résistance (IR) augmenté et asymétrique] en amont d’une occlusion ou d’une sténose serrée engendrée par la dissection. Ces signes indirects ont été historiquement les premiers décrits dans la dissection carotide ou vertébrale car les techniques ultrasonores utilisées il y a une trentaine d’années ne permettaient jamais de visualiser les signes morphologiques, contrairement à ce qui se passe maintenant.
En phase aiguë, quand le site de la dissection est accessible, une occlusion complète ou une sténose serrée de l’artère carotide interne ou vertébrale sont fréquemment observées. Les signes hémodynamiques ne sont pas différents de ceux que l’on observe dans les lésions athéromateuses : absence de flux pour l’occlusion, vitesses accélérées en proportion du degré de sténose en cas de réduction du chenal circulant.
Cependant, les sténoses entraînées par une dissection sont des sténoses longues et effilées ce qui implique que, même si elles sont en général sévères, les vitesses circulatoires peuvent ne pas être accélérées de façon strictement proportionnelle à la réduction de calibre et les turbulences peuvent manquer (figure 6). Il faut également se souvenir que les vitesses circulatoires peuvent être basses, lorsque la sévérité de la sténose est telle que le débit n’est plus maintenu. Le chenal circulant résiduel est généralement excentré et de position variable sur la surface de section au long de la zone disséquée en raison du trajet hél coïdal de la dissection (figure 7).
Figure 6. Modifications hémodynamiques en présence d’une dissection. A : accélération, sténose longue d’une ACI ; B : accélération, sténose longue d’une artère vertébrale ; C : occlusion d’une ACI (absence de flux, minime signal systolique lié au mouvement de paroi). DR
Figure 7. Chenal circulant résiduel excentré et de position variable au long de la zone disséquée en raison du trajet hélicoïdal de la dissection. 3 exemples : dissection d’une ACI (A et B), dissection d’une AV (C). DR
Le retentissement sur la circulation cérébrale est évalué en écho-Doppler transcrânien. L’EDTC recherche un amortissement des vitesses et une diminution de l’IR dans le territoire d’aval de la dissection, il évalue aussi la mise en jeu et l’efficacité des suppléances(17). Cet examen permet également le diagnostic d’une éventuelle extension intrapétreuse de la dissection.
Performances de l’échographie Doppler
Les conditions idéales pour pouvoir affirmer la dissection des artères cervicales sont réunies quand les informations morphologiques et hémodynamiques obtenues au site de la lésion sont concordantes : diagnostic d’une occlusion ou d’une sténose serrée chez un patient indemne de lésions athéromateuses et présentant un épaississement pariétal homogène de localisation particulière. Les études ne prenant en compte qu’une partie des informations sont toujours moins performantes.
La sensibilité de l’échographie Doppler pour le diagnostic de la dissection carotide est élevée, de l’ordre de 95 % (jusque 100 % pour certains auteurs), de même que la spécificité. La valeur prédictive positive et la valeur prédictive négative sont respectivement de 92 % et 97 %. Les performances sont moins bonnes lorsqu’il n’y a pas d’anomalie hémodynamique ou lorsqu’il s’agit d’une dissection vertébrale (sensibilité de l’ordre de 75 % seulement)(7,13,14).
Les limites de l’exploration ultrasonore sont essentiellement liées au caractère très distal de certaines dissections ou à l’absence d’anomalies hémodynamiques, soit réelles (pseudo-anévrysme sans sténose) soit apparentes (sub-occlusion). Ces limites reculent actuellement avec l’utilisation de sondes adaptées, avec l’apport des techniques récentes d’imagerie de flux et des agents de contraste(18,19). Comme c’est le cas pour l’ensemble des modalités d’imagerie, un examen écho-Doppler normal ne permet pas d’éliminer le diagnostic, d’autant plus qu’on se situe à distance des premiers signes cliniques. Un diagnostic de certitude est cependant obligatoire pour la mise en route du traitement, il est en général obtenu grâce à l’utilisation d’une deuxième modalité d’imagerie et au suivi évolutif. La grande majorité des équipes complète donc les données ultrasonographiques avec l’IRM-ARM ou l’angioscanner(4,8).
Diagnostic différentiel
Les autres causes d’épaississement pariétal et d’anévrysmes doivent être éliminées avant d’affirmer la dissection, en particulier la dysplasie fibromusculaire (en sachant qu’une association est toujours possible), les artériopathies inflammatoires et radiques (mais le contexte clinique et biologique est alors différent, l’épaississement plus diffus et situé sur des segments plus proximaux, parfois spécifiques de ces pathologies).
La dissection de l’aorte peut s’étendre aux artères à destinée encéphalique mais le contexte clinique est en général évocateur et les signes neurologiques ne sont pas au premier plan. Lorsqu’il existe une extension à l’artère carotide commune, l’aspect écho-Doppler est très différent de celui observé dans la dissection cervicale. On visualise en effet un lambeau intimal mobile dans la lumière et la présence de deux chenaux circulants. De plus, ces anomalies sont observées sur la partie proximale de l’artère et ne dépassent pas la bifurcation carotide (figure 8).
Figure 8. Dissection aortique étendue à un axe carotide. Flap intimal séparant 2 chenaux circulants bien visible dans le petit (A) et le grand (B) axe du vaisseau. La dissection s’arrête avant la bifurcation carotide (terminaison du faux chenal, borgne, bien visible en B). DR
Suivi évolutif
Un écho-Doppler de contrôle est effectué avant la sortie du patient puis à 6 mois, moment où vont être discutés les modifications ou l’arrêt du traitement médicamenteux. L’écho-Doppler cervical permet de surveiller l’évolution de la dissection qui est souvent rapidement favorable avec régression de l’hématome de paroi et recanalisation artérielle. Même à distance, il faut toujours réaliser un examen complet. Il faut en particulier rechercher une dissection dans les territoires initialement préservés, ce qui n’est pas exceptionnel alors même que le risque de récidive est très faible dans le territoire initialement concerné. Il faut être d’autant plus vigilant dans cette recherche qu’il existe une histoire familiale de dissection.
Par ailleurs, l’EDTC permet, lorsque des anomalies ont été détectées en phase aiguë, d’en assurer le suivi évolutif et de rechercher la normalisation des vitesses et de l’IR qui signent une évolution favorable.
IRM-ARM
L’IRM est actuellement l’examen de référence pour le diagnostic des dissections carotides. Le diagnostic positif repose sur la visualisation directe de l’hématome pariétal. La réalisation de coupes axiales pondérées en T1 avec saturation du signal de la graisse et pondération T2 permet d’obtenir le diagnostic de l’hématome subaigu avec une sensibilité et une spécificité de plus de 90 %. Ces coupes sont en général suffisantes pour évaluer l’extension en hauteur de la dissection. On observe un hypersignal de paroi correspondant à l’hématome intramural, hypersignal « en croissant », typique de la dissection (figure 9). La lumière artérielle résiduelle est visible sous la forme d’un hyposignal excentré, de calibre diminué. En cas d’occlusion complète de l’artère, on observe au contraire un hypersignal au sein de la lumière. Le diamètre externe est le plus souvent augmenté.
Figure 9. IRM T1 avec saturation. Aspect caractéristique de dissection : hypersignal de paroi en croissant (hématome intramural), hyposignal excentré (lumière artérielle résiduelle), diamètre externe augmenté. DR
Par contre, en phase très précoce aussi bien qu’à distance, au delà de 2 mois en général, l’hématome est iso-intense aux structures environnantes et donc plus difficile à reconnaître avec ces séquences(4,8,20).
L’interprétation peut également être difficile en cas de trajets artériels sinueux, ce qui est assez fréquent dans le territoire vertébral. La présence de plexus veineux en avant du plan artériel peut également gêner l’interprétation des images. Ceci est particulièrement vrai pour les segments V1-V2 des artères vertébrales. L’IRM n’est donc pas aussi performante dans le diagnostic de dissection des artères vertébrales (sensibilité 60 % et spécificité 58 %) qu’elle ne l’est dans le territoire carotidien(4).
Quoi qu’il en soit, l’IRM doit toujours être réalisée en cas de suspicion clinique et/ou ultrasonographique de dissection (figure 10). Réalisée trop précocement, elle peut cependant être négative pour les raisons techniques évoquées plus haut, un second examen est donc systématiquement prévu dans ce cas. L’imagerie des structures cérébrales doit être associée à l’examen cervical, à la recherche de lésions ischémiques ou hémorragiques.
Figure 10. A : ED cervical avec sonde linéaire : aspect normal ; B : ED cervical avec sonde micro-convexe et injection d’un agent de contraste ultrasonore : anomalie pariétale anécho- gène haut située en sortie de boucle de l’ACI, en faveur d’un hématome de paroi ; C : IRM séquence T1 avec saturation : image caractéristique de dissection ; D : ARM sténose effilée longue de l’ACI à distance du bulbe, en aval d’une boucle (même aspect qu’en ED mais évaluation plus facile en ARM de l’extension de la lésion). DR
L’ARM (figure 11) montre, en cas de sténose sévère, le rétrécissement typique sus-bulbaire de l’artère carotide interne « en queue de radis » au site de la dissection. Elle permet la détection et la surveillance des anévrysmes post-dissection. En temps de vol 3D, l’ARM est très performante dans le diagnostic de dissection de l’ACI (sensibilité 95 % et spécificité 99 % en référence à l’angiographie conventionnelle) ; en revanche, elle est nettement moins performante dans le diagnostic de dissection de l’artère vertébrale (sensibilité 20 %). Par ailleurs, l’ARM permet d’évaluer de façon très précise l’état des suppléances intracrâniennes, en particulier la fonctionnalité du polygone artériel de Willis.
Figure 11. Les 3 aspects pouvant caractériser une dissection en ARM : sténose (A), occlusion (B) ou anévrysme (C) sus-bulbaires. DR
Angioscanner
En cas de non disponibilité de l’imagerie par IRM, on peut réaliser un angioscanner. Cet examen permet de suspecter l’hématome de paroi en mettant en évidence un hyposignal autour de la lumière artérielle, mais cet aspect n’est pas spécifique de la présence d’un hématome. L’angioscanner permet aussi de quantifier une sténose ou de faire le diagnostic d’une occlusion.
D’après les données de la littérature, il semble que l’angioscanner soit une très bonne technique pour le diagnostic de dissection de l’artère vertébrale (sensibilité 100 %, spécificité 98 %). L’augmentation de diamètre est retrouvée chez tous les patients porteurs de dissection vertébrale, l’épaississement pariétal en croissant chez 80 % d’entre eux. L’aspect de flap intimal est plus rarement observé(4,8).
Artériographie conventionnelle
La place de l’artériographie conventionnelle est devenue mineure et cette technique n’est plus le « gold standard » en matière de dissection. Elle est actuellement réservée aux cas où il existe une discordance entre les examens d’imagerie non invasive, ce qui arrive principalement dans les suspicions de dissection vertébrale, et à ceux dans lesquels on recherche une dysplasie fibromusculaire. Le diagnostic angiographique de dissection repose sur l’aspect, le siège et l’évolution des lésions. Les signes angiographiques de dissection artérielle sont : la sténose longue, régulière et effilée, l’occlusion artérielle, l’anévrysme, le décollement intimal. La seule image pathognomonique est la double lumière artérielle, mais elle est exceptionnellement observée au niveau des artères cervicales(2,4,8).
L’imagerie non invasive a une place très importante dans le diagnostic et le suivi des dissections cervicales. Il est toujours indispensable d’associer des données morphologiques (signes en faveur d’un hématome de paroi : échographie, IRM) et des signes indirects ou hémodynamiques (signes de sténose serrée ou d’occlusion : ARM ou angioscanner, Doppler ou autres techniques ultrasonographiques d’imagerie de flux). Quelle que soit la technique utilisée, il est nécessaire de bien connaître les caractéristiques et l’évolutivité de cette pathologie pour éviter des erreurs d’interprétation. Chaque technique ayant ses propres limites, il est conseillé de toujours coupler deux examens d’imagerie, le plus souvent techniques ultrasonores et résonance magnétique. Les performances de l’échographie Doppler et de l’IRM-ARM sont en effet excellentes, en particulier pour le diagnostic de la dissection carotide. En revanche, l’angioscanner est plus performant en cas de dissection vertébrale, mais il est globalement peu utilisé. L’angiographie est d’usage beaucoup plus rare qu’auparavant, on peut y avoir recours lorsque les résultats des examens non invasifs sont contradictoires.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :