Technologies
Publié le 25 mar 2024Lecture 7 min
Angioplastie artérielle sous-inguinale : avec IVUS, la donne change
Gilles GOYAULT, Institut cardiovasculaire de Strasbourg, Clinique RHENA, France
Qui n’a jamais douté devant un contrôle angiographique après une angioplastie ? Qui ne s’est jamais dit que si on pouvait voir ce qui se passait dans la lumière du vaisseau, ce serait tellement mieux ?
Pourquoi ?
Qui n’a jamais douté devant un contrôle angiographique après une angioplastie ? Qui ne s’est jamais dit que si on pouvait voir ce qui se passait dans la lumière du vaisseau, ce serait tellement mieux ?
Nous rencontrons toutes et tous dans notre pratique quotidienne des situations d’incertitude. Nous ne savons pas toujours expliquer cette image angiographique perturbante malgré une double incidence, nous n’expliquons pas ce flux ralenti alors que la lumière artérielle paraît bien ouverte ou nous pensions avoir parfaitement positionné ce stent à l’ostium de l’artère fémorale superficielle et non pas 3 mm trop bas, lors de la reprise précoce pour thrombose, etc.
Alors pour parer à toutes ces situations, loin d’être anecdotiques, l’échographie endovasculaire (IVUS, Boston Scientific) est faite pour nous !
Comment ?
Bien qu’étant une technique d’imagerie utilisée depuis plus de 20 ans dans l’angioplastie coronaire, l’IVUS ne se développe que depuis peu dans le traitement endovasculaire de l’artériopathie oblitérante des membres inférieurs (AOMI) en Europe.
Il faut dire que les techniques et les indications de l’angioplastie percutanée dans l’AOMI se sont énormément développées ces dernières années, en particulier à l’étage fémoropoplité.
D’une époque où ce traitement endovasculaire se limitait à une angioplastie au ballon suivie de la mise en place d’un stent autoexpansible (longtemps surdimensionné), nous sommes passés à l’ère des dispositifs actifs, de l’athérectomie, de la lithotripsie (IVL) et des techniques avancées de recanalisation repoussant les limites techniques et les indications.
Malgré ces avancées majeures, la grande majorité reste fidèle à l’imagerie bidimensionnelle angiographique sans pousser plus loin le souhait de comprendre « de l’intérieur ». Maintenant que nous avons tous techniquement progressé, que nos patients resténosent moins, mais que nos résultats restent inférieurs à ceux de l’angioplastie coronaire, il est temps de passer à la 3D !
Plutôt curieux au départ, nous avons sauté le pas de l’IVUS dans notre centre depuis plus de 6 mois et avons opté pour la solution proposée par Boston Scientific incluant la console Avvigo et les sondes Opticross 0.018 et 0.035. La qualité d’image est excellente et la console très intuitive (le module d’intégration de la tablette de contrôle à la table d’angio est attendu avec impatience !).
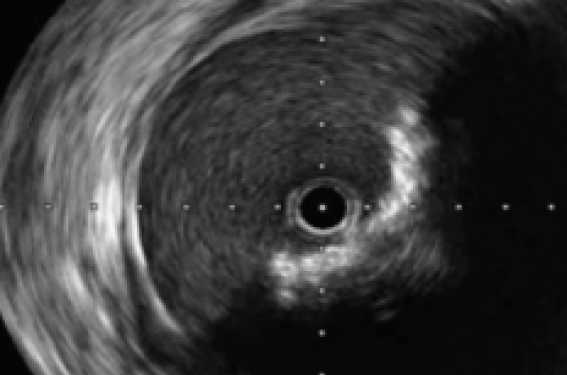
Il ne nous a pas fallu longtemps avant de constater les limites de l’imagerie angiographique, en particulier sur des contrôles que nous aurions considéré comme parfaits, etc. Quelle surprise de découvrir une sténose résiduelle de 50 % sur une plaque calcifiée, un flap de dissection sténosant ou une malaposition de stent, etc. (figures 1 et 2).
Figure 1. A. Angiographie sélective révélant une sténose préocclusive calcifiée du tiers inférieur de l’artère fémorale superficielle gauche chez un patient claudiquant. B. Image non soustraite permettant de visualiser les importantes calcifications et la sonde IVUS Opticross™ 0.018 en place. C. Image IVUS en amont de la sténose révélant un arc calcifié inférieur et latéral droit de 120° non sténosant de la média. D. Image IVUS sur la sténose préocclusive calcifiée avec atténuation complète du signal échographique en raison des calcifications circonférentielles. E. Image IVUS à la partie distale de la plaque révélant un arc calcifié non sténosant quasi-circonférentiel.
Figure 2. A. Angioplastie à l’aide d’un ballon actif Ranger™ 7 x 100 mm après préparation du vaisseau à l’aide d’un ballon non compliant Athletis™ 7 x 40 mm. B, C et D. Contrôles angiographiques de face, en OAD 25° et OAG 35° ne révélant pas de sténose résiduelle significative. E. Image IVUS au niveau de la sténose préocclusive initiale révélant une belle ouverture de la lumière mais une sténose résiduelle significative visuellement. F. Image IVUS post-traitée confirmant une sténose résiduelle de 46 % en surface et de 44 % en diamètre. La discordance entre l’imagerie angiographique et l’IVUS est évidente. Que faire ? La sténose résiduelle a été tolérée compte tenu du gros diamètre de l’artère et de l’excellent flux. Une surveillance rapprochée a été instaurée (absence de resténose significative à 6 mois).
Alors, en quoi l’IVUS fait mieux que l’angiographie traditionnelle ?
Par une exploration endoluminale et pariétale tridimensionnelle, l’intérêt de l’IVUS se retrouve à toutes les étapes de l’angioplastie : franchissement, préparation du vaisseau et traitement (tableau 1).
Dans le cadre des lésions occlusives, l’IVUS permet de situer le guide au sein de l’occlusion et de guider un trajet endoluminal ou une réentrée.
Une fois la lésion franchie, l’IVUS permet l’analyse précise de la plaque : son caractère calcifié, fibreux ou mou (± lipidique), la présence ou non de thrombus, son degré de sténose, sa longueur, son extension circonférentielle (on parlera d’arc à 180°, par exemple, en cas d’atteinte hémicirconférentielle) et sa surface globale (par soustraction de la lumière circulante à la surface externe du vaisseau).
Par convention, le diamètre du vaisseau est déterminé par la limitante élastique externe, apparaissant sous la forme d’un liseré hypoéchogène.
De l’analyse de la plaque découlera le choix de la modalité optimale de préparation du vaisseau : athérectomie, IVL, thromboaspiration, angioplastie au ballon avec un diamètre optimisé (tendance à la sous-dilatation d’environ 25 % à l’étage jambier sur les seules données de l’angiographie, par exemple).
Une fois le vaisseau bien préparé, l’IVUS aidera au choix du traitement le plus adapté : ballon actif ou stent.
Enfin, le contrôle IVUS final permettra d’analyser avec précision le degré de sténose résiduelle, la bonne apposition d’un stent, mais également d’éliminer une éventuelle dissection significative et son extension intimale, médiale ou sous-adventielle, facteurs pronostiques de perméabilité.
Mais quel intérêt de ces images et données dans notre pratique clinique ?
Plus avancés sur cette technologie, les États-Unis, et surtout le Japon, nous ouvrent la voie.
De plus en plus de publications explorent l’intérêt d’introduire cette modalité d’imagerie dans notre pratique.
À l’heure actuelle, il n’y a pas de recommandations sur l’utilisation de l’IVUS dans l’AOMI mais un consensus d’experts publié par Secemsky et coll. en 2022 dans le JACC, confirmant l’intérêt de l’IVUS dans toutes les étapes du traitement endovasculaire, en particulier aux étages fémoropoplités et jambiers (tableau 2).
Tableau 2. Consensus d’experts sur l’utilisation de l’IVUS dans le traitement endovasculaire de l’AOMI, d’après Secemsky et al. JACC 2022.
Un seul essai randomisé portant sur 150 patients a pour le moment été publié sur le sujet par Allan et coll. dans le JACC en 2022. Il compare la perméabilité à 1 an de lésions fémoropoplitées entre un groupe de patients avec angio seule et un groupe avec angio + IVUS. Il révéle un changement du plan de traitement dans presque 79 % des cas après utilisation de l’IVUS et confirme l’objectif primaire avec une absence de resténose de 72,4 % dans le groupe angio + IVUS vs 55,4 % dans le groupe angio seule (p = 0,008). D’importantes cohortes multicentriques ont été publiées par les équipes japonaises, dont une en 2017 par Fujihara et coll. dans le JEVT, portant sur 85 649 patients dont 50 925, soit 60 %, avec IVUS. L’étude révèle un taux d’amputation à 1 an (objectif primaire) de 6,9 % dans le groupe angio + IVUS vs 9,3 % dans le groupe angio seule (p < 0,001) avec une réduction du coût global dans le groupe IVUS.
Ces observations confirment celles déjà publiées par Lida et coll. dans le JEVT en 2014 portant sur l’extraction de 468 patients de la cohorte REAL-PT et comparant deux groupes de 234 patients traités avec ou sans utilisation de l’IVUS. Les résultats sont très significativement (p < 0,001) en faveur de l’IVUS en termes de perméabilité primaire, d’absence de réintervention, d’absence d’événement indésirable du membre traité et de survie sans événement.
Aux États-Unis, le taux moyen d’utilisation de l’IVUS est de 12 % dans les interventions artérielles périphériques, atteignant quasiment 40 % dans les « office based lab » (OBL), les praticiens cherchant très probablement à sécuriser au maximum les résultats des angioplasties de leurs patients ambulatoires.
Une littérature manquant encore de puissance mais une tendance générale en faveur du bénéfice de l’IVUS, etc.
Où serait donc le(s) frein(s) ?
Bien que très ergonomique et facile à mettre en œuvre, l’IVUS nécessite un apprentissage préalable de la sémiologie échographique pour permettre une exploitation optimale des données et maximiser le bénéfice clinique attendu. Cet apprentissage est cependant loin d’être insurmontable.
Un autre frein est de nature économique, l’IVUS ajoutant un coût à l’intervention. Un travail français est à mener pour prouver aux autorités le bénéfice économique de son utilisation comme cela a pu être fait par nos collègues japonais !
Conclusion
Plutôt curieux au départ et sans vraiment appréhender le bénéfice d’une technique d’imagerie supplémentaire à l’angiographie, apportant déjà un haut niveau de satisfaction dans la grande majorité des cas, nous avons été très surpris par la quantité d’informations supplémentaires fournies par l’IVUS (Boston Scientific) et son impact dans nos choix thérapeutiques. Cette nouvelle modalité révèle les imperfections de nos traitements, non visibles par l’imagerie angiographique bidimensionnelle traditionnelle.
Une question vient à l’esprit : n’avons-nous pas à notre disposition des dispositifs médicaux nous permettant déjà d’améliorer les taux de perméabilité primaire et de réduire les taux de réintervention si nous les utilisions de manière optimale ? L’IVUS serait donc peut-être le maillon manquant pour optimiser nos traitements et exploiter pleinement les qualités des ballons, stents ou systèmes d’athérectomie déjà disponibles, etc.
Questions sans réponse pour le moment mais qui mérite sûrement que l’on tente d’y répondre !
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


