Publié le 01 mar 2011Lecture 18 min
Actualités en pathologie valvulaire
A. MIGNOT et M. DIJOS, Hôpital Cardiologique de Bordeaux

Les Journées d’écho-Doppler de Bordeaux
Sclérose aortique : marqueur de risque cardiovasculaire ?
D. Mohty (Limoges)
La calcification de la valve aortique est un processus lent allant de la sclérose aortique (épaississement des sigmoïdes) à la calcification valvulaire sévère avec diminution de l’ouverture des sigmoïdes générant un rétrécissement aortique. La sclérose aortique est une atteinte fréquemment rencontrée chez le sujet âgé avec une prévalence atteignant 48 % après 84 ans. Pendant longtemps, elle a été considérée comme un processus dégénératif « passif » lié au vieillissement des tissus. Cette conception est aujourd’hui largement remise en cause.
En effet, de multiples études ont démontré des similitudes physiopathologiques entre les mécanismes de formation de la sclérose aortique et les phénomènes de développement de l’athérosclérose. Il s’agirait alors d’un processus actif de remodelage tissulaire.
Sur le plan histologique tout d’abord, les lésions précoces retrouvées dans la sclérose aortique sont comparables à celles retrouvées dans l’athérosclérose : dépôts d’apolipoprotéines, infiltration de macrophages et de lymphocytes T et processus inflammatoire chronique à l’origine des calcifications(1).
Sur le plan clinique, des études observationnelles ont démontré une similitude entre les facteurs de risque de développement de la sclérose aortique et ceux de l’athérosclérose avec en particulier l’âge, le sexe masculin, l’hypertension artérielle, le tabagisme, le taux de lipoprotéine(a) et celui du LDL-cholestérol(2). De même, il existe une corrélation entre sévérité de l’atteinte coronarienne et importance des calcifications de la valve aortique. Enfin, il a été démontré que la sclérose aortique est associée à une augmentation de la morbi-mortalité de façon indépendante avec par exemple une augmentation de 50 % du risque de décès de cause cardiovasculaire(3). Pourtant, un certain pourcentage de patient présentant une sténose aortique n’a aucun facteur de risque cardiovasculaire et la plupart des patients coronariens ne présentent pas de sténose aortique associée. De même, aucune étude randomisée n’a pu démontrer l’efficacité des statines dans la réduction de l’évolutivité de la sténose aortique (étude SALTIRE, étude SEAS) malgré une franche diminution du taux de LDL-C.
Ces éléments suggèrent que la sclérose aortique n’est pas un phénomène essentiellement athéroscléreux et que d’autres mécanismes sont impliqués encore mal connus, tels que l’influence des facteurs génétiques, le rôle potentiel des métallo-protéinases matricielles, et l’implication du système rénine angiotensine aldostérone (figure 1).
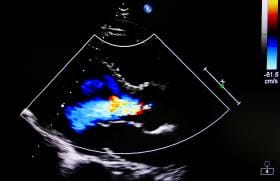
Figure 1. Évaluation de la sténose aortique par écho-Doppler.
Proposition d’un score de risque dans le RA asymptomatique
J.-L. Monin (Créteil)
Si l’indication chirurgicale est formelle en cas de rétrécissement aortique calcifié sévère et symptomatique, selon les recommandations européennes et américaines, la prise en charge opératoire précoce des patients asymptomatiques reste sujette à discussion(4).
L’indication chirurgicale est indiscutable en cas de symptômes et de critères de sévérité du RAC définis de la manière suivante :
- vitesse maximale (Vmax) > 4 m/s,
- surface valvulaire aortique < 1 cm²,
- gradient moyen transvalvulaire aortique > 40 mmHg.
Dans le cadre du RAC sévère et asymptomatique, la place de l’échocardiographie transthoracique dans le diagnostic du RAC est de classe I et recommandée dans le suivi des patients asymptomatiques chaque année en cas de RAC sévère avec une classe I et niveau d’évidence B.
• Le test d’effort est également utile pour démasquer des critères cliniques et électrocardiographiques de mauvais pronostic. Il est recommandé dans le RAC asymptomatique pour le dépistage de patients à risque d’événements cardiovasculaires (symptômes à l’effort, sous-décalage ST > 2 mm, arythmies ventriculaires, absence d’élévation de la pression artérielle > 20 mmHg ou chute de la pression artérielle par rapport au niveau basal). En cas de critères positifs du test d’effort, une chirurgie de RVAO doit être proposée avec un niveau de preuve classe IIb et niveau d’évidence C.
Une autre indication chirurgicale est mentionnée avec un niveau de preuve similaire en cas de RAC asymptomatique très serré (surface non indexée < 0,6 cm², gradient moyen transvalvulaire > 60 mmHg, Vmax > 5 m/s) associée à une mortalité opératoire prédite faible ≤ 1 % (classe IIB, niveau d’évidence C).
De plus, dans le cadre des patients dits « progresseurs rapides » (élévation de la Vmax de 0,3 m/s/an) avec un degré important de calcifications, la chirurgie de RVAO est également recommandée avec un niveau de preuve IIa.
Enfin, en cas de sténose valvulaire aortique modérée chez un patient devant bénéficier d’une revascularisation par pontage aorto-coronarien, la chirurgie de RVAO combinée est également recommandée avec un niveau de preuve IIa.
• De nombreuses équipes se sont intéressées à la prédiction du risque d’événements cardiaques chez les patients porteurs de RAC sévères asymptomatiques, afin de mieux sélectionner les patients devant bénéficier d’une chirurgie précoce.
Rosenhek et coll. ont démontré que la mesure de la Vmax est un paramètre, d’une part, prédictif d’événements cardiaques et de symptômes et, d’autre part, douée d’une excellente reproductibilité de l’ordre de 5 à 7 %, en comparaison notamment avec la mesure de la surface valvulaire aortique, qui nécessite une moyenne sur 3 mesures(5).
Lim et coll. ont démontré dans une population de patients porteurs de RAC serrés symptomatiques (n = 53) et asymptomatiques (n = 17) plusieurs éléments intéressants(6) :
- le BNP est très bien corrélé à la classe NYHA et augmente avec le niveau de NYHA (p < 0,01) ;
- seul le BNP est prédictif en analyse multivariée du caractère symptomatique du RAC et le BNP a une meilleure aire sous la courbe (0,86) que la surface valvulaire aortique (0,28) dans la prédiction du caractère symptomatique ;
- une valeur du BNP > 66 pg/ml permet de détecter les patients symptomatiques avec un excellente sensibilité (84 %) et spécificité (82 %) ;
- une valeur du BNP ≥ 97 pg/ml est un facteur de risque puissant et indépendant de décès d’origine cardiaque après ajustement avec l’âge et la classe NYHA.
• Une stratification du risque opératoire des patients asymptomatiques par une approche multiparamétrique a été proposée par l’équipe du CHU d’Henri Mondor(7).
• L’étude de développement de ce score de risque a été menée de manière prospective sur une population de 104 patients d’âge moyen 72 ans, porteurs de RAC sévère (Vmax 4,1 m/s) asymptomatiques. Les événements à 24 mois étudiés étaient le décès (toutes causes), la survenue de symptômes ou un test d’effort positif (dyspnée, angor, syncope ou équivalent lipothymique, élévation de la pression artérielle < 20 mmHg, sous-décalage ST d’au moins 2 mm, arythmies ventriculaires) à l’origine d’un remplacement valvulaire aortique. Outre les paramètres échocardiographiques conventionnels, les auteurs ont également évalué la population par un dosage du BNP à l’inclusion et au cours du suivi prospectif des patients.
Les résultats ont permis d’identifier 3 facteurs prédictifs indépendants d’événements : le sexe féminin, la vitesse maximale et le taux initial de BNP. Les auteurs ont choisi de combiner ces 3 paramètres dans un score de risque selon la formule suivante : Score = (Vmax (m/s) x 2) + (Log N (BNP) x 1,5 (sexe féminin)
• La validation de ce score a été obtenue dans une population similaire de 104 patients asymptomatiques pris en charge au CHU Sart Tilman de Liège. L’analyse de ces deux cohortes a montré (figures 2 et 3) que le taux d’événements est fortement influencé par la valeur initiale de ce score. Ainsi, le taux d’événements à 20 mois est de 4 à 7 % dans le 1er quartile (score = 12,9), contre 80 à 85 % dans le 4e quartile (score = 19,7).
Une validation de ce score sur une cohorte de plus grand effectif est en cours, mais son utilisation apparaît d’ores et déjà très pertinente pour prédire les patients à haut risque, notamment quand un facteur de risque tel que le sexe ou le BNP fait défaut, et ainsi permettre un « rattrapage » dans l’évaluation du risque global du patient. Jean-Luc Monin a cependant insisté en conclusion sur la seule place des recommandations dans la décision opératoire, à l’heure actuelle, et rappelé ainsi l’importance d’une surveillance régulière afin de choisir le meilleur moment pour la chirurgie de remplacement valvulaire aortique.
Figure 2. Cohorte de développement du score (Henri Mondor).
Figure 3. Cohorte de validation du score (Liège).
Rétrécissement aortique et bas débit paradoxal : mythe ou réalité ?
P. Pibarot (Québec)
Le rétrécissement aortique à « bas débit paradoxal » est une entité clinique décrite pour la première fois en 2007(8) qui se caractérise par :
- une surface valvulaire aortique ≤ 1cm²,
- un gradient moyen transvalvulaire ≤ 40 mmHg,
- une FeVG préservée (≥ 50 %),
- et un volume d’éjection indexé par rapport à la surface corporelle ≤ 35 ml/m².
Selon plusieurs études, la prévalence de cette entité est de 25 à 35 %(8-10). Les patients concernés sont plus souvent âgés, de sexe féminin, avec un remodelage concentrique prononcé (rapport paroi/cavité > 0,47), et une petite cavité ventriculaire gauche (DTDVG ≤ 47 mm) à l’origine d’une anomalie de remplissage diastolique. Cette population pose le problème à la fois du diagnostic et de la prise en charge thérapeutique, en raison de la discordance des critères échocardiographiques de surface et de gradient.
Trop de cliniciens accordent une importance plus importante à la mesure du gradient transvalvulaire aortique par rapport à la surface valvulaire aortique, ce qui conduit à une sous-estimation de la gravité de cette maladie et par conséquent à une moindre prise en charge chirurgicale de ces malades.
Philippe Pibarot a insisté sur l’importance, avant de conclure à un RAO avec bas débit paradoxal, de ne pas omettre, d’une part, la possibilité d’une erreur de mesure (de la surface valvulaire aortique ou du gradient moyen transvalvulaire aortique) et, d’autre part, une autre entité clinique qui est le RA à bas débit et bas gradient.
Il faut donc d’abord réitérer ces mesures, rechercher la présence d’éléments caractéristiques du RA avec bas débit paradoxal (remodelage concentrique et petite cavité ventriculaire gauche), et utiliser des méthodes pour corroborer la sévérité de la sténose. Ainsi, l’évaluation du degré de calcifications valvulaires aortiques par scanner cardiaque est très bien corrélée à la surface valvulaire aortique. Un score calcique > 1651 AU (arbitrary units) permet en outre avec une très bonne performance statistique de différencier les sténoses aortiques vraies des pseudo-sténoses, en cas de dysfonction ventriculaire gauche (FeVG < 40 %)(11). L’échocardiographie de stress à la dobutamine ou à l’effort permet de d’objectiver l’augmentation du gradient avec le débit (≥ 18-20 mmHg) sans augmentation de la surface valvulaire aortique, et donc de distinguer un RAO serré vrai d’une sténose relative(12).
Après cette évaluation approfondie grâce aux différents outils technologiques et une fois le diagnostic confirmé de RAO serré avec bas débit paradoxal, le caractère symptomatique doit conduire à une prise en charge chirurgicale, le bénéfice sur la survie du patient, ayant pu être démontrée notamment dans une étude en cours de publication et présentée tout récemment à l’ESC par Clavel et coll. (publication en cours).
Endoprothèses valvulaires en 2010 : rôle de l’échocardiographiste avant, pendant, après
E. Brochet (Paris)
Le remplacement valvulaire aortique par bioprothèse percutanée a connu, ces dernières années, un remarquable essor révolutionnant la prise en charge thérapeutique des patients avec rétrécissement aortique serré symptomatique présentant une contre-indication chirurgicale ou un risque opératoire trop élevé. Cependant, il existe des contraintes techniques nécessitant une grande rigueur dans la sélection des patients éligibles pour cette procédure. L’imagerie « multimodalités » (angioscanner, fluoroscopie, échographie-Doppler) va jouer un rôle fondamental dans cette sélection mais aussi dans le monitoring de la procédure et l’évaluation postimplantation. L’échocardiographie a démontré son intérêt durant ces différentes étapes(13).
Sélection des patients : analyse échocardiographique transthoracique complète
- confirmation de la présence d’une sténose aortique serrée, élimination des autres étiologies possibles responsables de la symptomatologie. Utilisation de l’échographie dobutamine dans les cas de bas gradient avec dysfonction systolique ventriculaire gauche ;
- analyse des feuillets valvulaire : recherche d’une bicuspidie ;
- mesure du diamètre de l’anneau aortique +++ au niveau de l’insertion des cusps, du sinus de Valsalva, de l’aorte ascendante. Analyse de l’aorte thoracique horizontale à la recherche d’athérome exubérant ;
- analyse du ventricule gauche : degré d’hypertrophie avec notamment recherche d’un bourrelet sous-aortique et d’un gradient d’obstruction intraventriculaire, fonction systolique et recherche d’un thrombus apical ;
- recherche d’une valvulopathie mitrale ;
- quantification des pressions pulmonaires.
L’échocardiographie transœsophagienne est indiquée en cas de mauvaise fenêtre ultrasonore ne permettant pas d’évaluer les éléments sus-cités, en cas de calcification importante ou de dimension du diamètre de l’anneau aortique approchant les valeurs limites d’implantation avec la réalisation d’une ETO systématique pour un anneau en ETT ≥ 24 mm.
Contre-indications échocardiographiques des endoprothèses aortiques
- Diamètre anneau aortique < 19 mm ou > 27 mm*
- Dilatation aorte ascendante > 45 mm ou sinus de Valsalva < 30 mm pour prothèse Corevalve
- Thrombus intraventriculaire gauche
- Hypertrophie sous-aortique sévère ou obstruction intraventriculaire gauche
- Valvulopathie mitrale sévère
- Athérome aortique exhubérant
Notons que la bicuspidie aortique ne constitue plus une contre-indication formelle mais nécessite une évaluation au cas par cas.
En ce qui concerne la mesure du diamètre de l’anneau aortique, l’étude de Messika-Zeitoun et coll. a démontré, sur 45 patients devant bénéficier d’une endoprothèse aortique, que les valeurs recueillies par échocardiographie transthoracique, transoesophagienne et par scanner sont bien corrélées(14). Pour autant, elles ne sont pas identiques avec une différence de 1,52 ± 1,11 mm entre scanner et ETO. Cette différence est en revanche négligeable entre ETT et ETO (0,6+/-0,8 mm). Pour autant et en l’absence de recommandation sur la technique préférentielle, l’échocardiographie a montré un bon résultat clinique avec un seul patient sur 34 présentant en postprocédure une régurgitation aortique de haut grade.
Pendant la procédure
L’échocardiographie transœsophagienne a un rôle fondamental durant cette phase :
- ultime mesure du diamètre de l’anneau aortique pour le choix de la taille de la prothèse (prothèse Edwards 2 tailles : 23 et 26 mm, prothèse Corevalve 2 tailles : 26 et 29 mm) ;
- aide au positionnement du guide dans le ventricule gauche (abord fémoral) ou dans l’aorte (abord transapical), aide au positionnement correct de la prothèse au niveau de la valve ;
- évaluation du résultat final postimplantation ; en particulier recherche d’une régurgitation aortique intra- ou paraprothétique ++ ;
- recherche de complications immédiates postimplantation : tamponnade, dissection aortique, insuffisance mitrale, dysfonction ventriculaire sévère liée à l’occlusion des ostia coronaires.
L’échocardiographie transœsophagienne standard est utilisée lorsque la procédure est réalisée sous anesthésie générale mais elle est mal tolérée chez les patients vigiles.
Ainsi, une approche par micro sonde ETO pour les interventions sous anesthésie locale a été également récemment développée à l’Hôpital Bichat (Paris) avec une qualité d’image satisfaisante.
Après la procédure
Le suivi du fonctionnement prothétique en postimplantation va être essentiellement réalisé par échocardiographie transthoracique. Tout d’abord à J1 après l’implantation, il est nécessaire de contrôler l’absence d’épanchement péricardique, de rechercher une fuite intra- ou paraprothétique avec quantification et nombre de jets, d’évaluer le positionnement et l’aspect de la prothèse ainsi que la cinétique des cusps, de rechercher une régurgitation mitrale et enfin d’évaluer la fonction systolique ventriculaire gauche. Avant la sortie du patient, outre ces éléments, il est nécessaire de mesurer le gradient transprothétique qui servira de gradient de référence et de mesurer la surface valvulaire fonctionnelle. Ces éléments seront recueillis également à chaque visite de contrôle.
L’échocardiographie selon ces différentes modalités présente donc un impact décisionnel majeur dans les différentes phases de la prise en charge des rétrécissements aortiques par endoprothèse que ce soit pour l’évaluation de la faisabilité, le guidage per procédure ou le suivi des patients.
Prise en charge de l’insuffisance mitrale organique en 2010
R. Rosenhek (Vienne, Autriche)
Les objectifs de la prise en charge en charge chirurgicale de l’insuffisance mitrale organique en 2010 devraient se résumer à la nécessité de préserver la fonction systolique ventriculaire gauche, et de réaliser autant que possible une réparation valvulaire pour diminuer la morbi-mortalité opératoire des patients concernés.
La place de l’échocardiographie dans la stratification du risque de mortalité cardiaque liée à l’existence d’une IM organique sévère est incontournable.
Il a été clairement démontré qu’une FeVG préopératoire < 60 % est un facteur prédictif de mauvais pronostic postopératoire(15) et qu’une valeur seuil de la surface de l’orifice régurgitant (SOR) > 40 mm² est associée à une mortalité opératoire de 40 % à 5 ans, y compris en l’absence de symptomatologie clinique(16).
La volonté en 2010 de déterminer des critères de stratification du risque échocardiographique est directement liée aux résultats de nombreuses études qui se sont intéressées à la faisabilité et à la mortalité relative à la chirurgie valvulaire mitrale conservatrice en comparaison avec la chirurgie conventionnelle de remplacement valvulaire. En effet, il a pu être démontré que la mortalité opératoire liée à un remplacement valvulaire mitral est bien supérieure à celle retrouvée en cas de chirurgie conservatrice(17). Les recommandations concernant la prise en charge chirurgicale de l’IM organique, placent par conséquent la réparation valvulaire, lorsqu’elle est faisable, en première intention dans le choix thérapeutique(18). Mais des travaux récents ont également pu mettre en évidence de grandes variations concernant l’option chirurgicale, y compris dans des centres à haut volume hospitalier où la mortalité opératoire est estimée faible. Ainsi Gammie et coll. ont montré que le taux de réparation valvulaire avait clairement augmenté entre 2000 et 2007 en passant de 50 à 70 %(19) et, alors même que la mortalité opératoire de la chirurgie n’était que de 1 % dans des centres entrainés, la plastie mitrale n’était réalisée que dans un quart des cas(20). De manière un peu provocatrice, Anyanwu et coll. vont jusqu’à parler de la loterie de la chirurgie valvulaire mitrale en mettant en avant le caractère trop variable de la chirurgie réparatrice, y compris dans de grandes équipes en dépit d’une morbi-mortalité opératoire élevée en cas de remplacement valvulaire mitral(21).
Pour mieux évaluer le risque global des patients porteurs d’une IM organique sévère et déterminer le moment opportun d’une chirurgie qui devra être conservatrice chaque fois que cela est réalisable, bon nombre de paramètres notamment échocardiogaphiques on été validés de manière pronostique. On pourra retenir :
- qu’une taille de l’oreillette gauche mesurée en TM ≥ 70 mm(22) et qu’un volume de l’oreillette gauche > 40 ml/m²(23) sont associés à un sur-risque d’événements cardiaques ;
- qu’une PAPS au repos ≥ 50 mmHG(24) et une HTAP à l’effort > 60 mmHg(25) sont prédictives d’événements cardiovasculaires ;
- au même titre qu’un diamètre télédiastolique du VG > 45 mm(18).
Ainsi, les recommandations européennes et américaines placent l’évaluation échocardiographique au centre de la décision opératoire avec des niveaux de preuve satisfaisants(18) :
La survie des patients porteurs d’une IM organique a donc été considérablement améliorée grâce à la plus grande place de la chirurgie mitrale réparatrice. Un certain nombre de paramètres échocardiograhiques sont validés et recommandés, afin de mieux appréhender le risque de ces patients, et leur permettre de bénéficier à temps d’une prise en charge chirurgicale adaptée.
Flash d’actualité : les infections du matériel de stimulation cardiaque
Expérience de Bordeaux
P. Bordachar (Bordeaux)
Le nombre d’implantations de matériel de stimulation a très nettement augmenté ces dernières années. Malheureusement, le risque infectieux est présent et le pourcentage d’infection de matériel de stimulation à triplé, qu’il s’agisse d’infection locale dans la plupart des cas ou de véritables endocardites sur sondes avec présence de végétations et hémocultures positives. L’échographie transœsophagienne est indiquée dans tous les cas de suspicion d’infection de matériel de stimulation à la recherche principalement de végétations et pour mesurer leur taille et leur mobilité. Lorsque le diagnostic d’endocardite sur sonde, avec présence de végétation est confirmé, le traitement repose sur une antibiothérapie prolongée (4 à 6 semaines) et une extraction du matériel. L’antibiothérapie, en cas d’infection uniquement locale a une durée plus courte (2 semaines).
Le diagnostic n’est pourtant pas toujours facile et le praticien est confronté à des situations telles que la présence d’un syndrome infectieux persistant sans signe local d’infection au niveau du boitier ni végétation visibles en échographie transœsophagienne.
Dans ces situations, l’équipe bordelaise s’est intéressée à l’apport du TEP scan comme aide au diagnostic d’endocardite sur sondes par la mise en évidence de signes scintigraphiques d’inflammation au niveau de celles-ci. Une étude est en cours.
Actualités sur les valvulopathies et le benfluorex
Y. Jobic (Brest)
Le benfluorex est un dérivé de la fenfluramine partageant le noyau phényléthylamine de l’amphétamine halogénée sur le noyau en CF3. Il a été commercialisé en 1976 en Europe, en Asie et en Amérique du Sud, initialement comme traitement adjuvant des hypertriglycéridémies et du diabète de type 2 chez des patients présentant une surcharge pondérale.
Une étude rétrospective menée par les équipes de Brest et d’Amiens a démontré que l’exposition au benfluorex (après ajustement sur le poids, le diabète et l’utilisation de dexfenfluramine) est associée à un surcroît de risque d’insuffisance mitrale restrictive(1). Les auteurs ont étudié l’ensemble des cas d’insuffisance mitrale rapportés entre 2003 et 2009 grâce aux codes PMSI. Ils ont distingué les cas d’insuffisance mitrale expliqués (groupe contrôle = 54 sujets) par une pathologie évidente (dégénérative, endocardite, rhumatismale, fonctionnelle), des cas d’insuffisance mitrale inexpliquée (groupes cas = 27 sujets). Les résultats de cette étude cas-témoins sont en faveur d’une augmentation statistiquement significative de l’utilisation de benfluorex dans le groupe des IM inexpliquées par rapport au groupe contrôle (IM d’étiologie déterminée) (tableau 1). Ainsi, Tribouilloy et coll. démontrent que la prévalence des IM inexpliquées et exposées au benfluorex est de 36 %(2).
Les résultats de l’étude prospective REGULATE menée par la CNAM en 2009 vont dans le même sens ; un million de diabétiques sont concernées, dont 43 208 ont été exposés au benfluorex. Le risque de développer une IM est multiplié par 1,6 et de remplacement valvulaire mitral par 3,6. Ces conclusions ont conduit le 30 novembre 2009 à la suspension d’autorisation de mise sur le marché de Médiator et de ses deux génériques. Le retrait définitif a été ainsi obtenu la 14 juin 2010, devant le risque avéré de valvulopathies restrictives.
Le mécanisme des lésions valvulaires sous benfluorex apparaît lié à un de ses métabolites, le norfenfluramine, qui exerce un effet agoniste sur des récepteurs sérotoninergiques nommés 5HT2B, très exprimés au niveau des valves cardiaques et dont l’action est fibrosante par prolifération des fibroblastes et augmentation de la production de glycosaminoglycannes (figures 4 et 5). Les agonistes des récepteurs 5HT2B comme l’Ecstasy ou certains antiparkinsoniens ont potentiellement ce type d’effet secondaire, avec un lien direct entre la dose et la durée d’exposition(2,3).
Au total, deux millions de Français ont été exposés au benfluorex depuis 1976, soit après 33 ans de commercialisation. Le principal diagnostic différentiel est l’origine rhumatismale. Il est important de penser à cette étiologie, dont l’histoire naturelle est mal connue, en cas d’IM inexpliquée, notamment chez des sujets de sexe féminin, obèses (IMC > 30 kg/m²), diabétiques avec une valvulopathie à l’échocardiographie de mécanisme restrictif, et ayant au minimum étaient exposés 3 mois au benfluorex.
Figure 4. Mécanismes de toxicité au niveau de la valve mitrale des drogues liées aux récepteurs sérotoninergiques 5HT2b(2).
Figure 5. Exemple d’une double valvulopathie mitrale (gauche) et aortique (droite) au benfluorex caractérisé par un épaississement nacré, une rétraction des feuillets en rapport avec la fibrose valvulaire(3).
À propos des valvulopathies
Nouvelles recommandations dans la prise en charge des endocardites bactériennes
G. Habib (Marseille)
En 2009 ont été publiées les nouvelles recommandations ESC concernant la prise en charge des endocardites bactériennes(1). Si les profondes modifications dans le domaine de l’antibioprophylaxie, avec une restriction de l’utilisation des antibiotiques pour les patients porteurs des cardiopathies les plus à risques, ont été largement remarquées et commentées, le Pr Gilbert Habib a souhaité mettre l’accent sur les changements dans le domaine de la prise en charge thérapeutique et notamment chirurgicale des endocardites bactériennes. En effet, le traitement des endocardites infectieuses repose sur une antibiothérapie prolongée et, pour environ la moitié des patients, sur un traitement chirurgical d’éradication des tissus infectés.
Les recommandations ESC ont permis de préciser ces indications chirurgicales et, surtout, pour la première fois de préciser quel est le « timing » optimal de la chirurgie.
La tendance globale est actuellement une chirurgie plus précoce avec réparation valvulaire quand cela est possible.
Les trois principales complications nécessitant une prise en charge chirurgicale en urgence sont l’insuffisance cardiaque, l’infection non contrôlée et la prévention des événements emboliques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :