Cardiomyopathies
Publié le 05 juin 2012Lecture 8 min
Cardiomyopathie dilatée et coronarographie normale - Doit-on pousser le bilan et comment ?
M. GALINIER, O. LAIREZ, S. MEJEAN, P. MAURY, P. FOURNIER, M. BERRY, J. RONCALLI, M. ELBAZ, A. PATHAK, CHU de Rangueil, Toulouse

La première étape du bilan étiologique d’une cardiopathie dilatée de cause inconnue consiste, le plus souvent, à rechercher une maladie coronarienne du fait du bénéfice de la revascularisation. En effet, 15 % environ des insuffisances cardiaques ischémiques correspondant à des lésions multitronculaires sont silencieuses. Les difficultés d’interprétation de l’échocardiographie et des tests d’ischémie myocardique chez ces patients imposent, dans la majorité des cas, une visualisation du réseau coronarien, soit par angioscanner chez les plus jeunes à faible niveau de risque d’athérosclérose, soit par coronarographie. À l’issue de ces examens, la maladie coronarienne athéromateuse étant éliminée en l’absence de sténose ≥ 50 %, on porte le diagnostic de cardiomyopathie dilatée (CMD) à coronaires angiographiquement normales.
En dehors, des situations cliniques où l’étiologie de la cardiomyopathie est évidente, comme dans les formes familiales marquées par de lourds antécédents chez les ascendants ou certaines formes sporadiques, si par exemple la CMD survient au décours d’une grossesse ou d’une chimiothérapie connue pour sa cardiotoxicité, un bilan étiologique précis s’impose à la recherche d’une cause pouvant être améliorée par un traitement spécifique. Alors que le plus souvent cette enquête demeurait négative, amenant à parler de CMD idiopathique, cette étape, indispensable dans la prise en charge des CMD a été grandement améliorée par l’imagerie par résonance magnétique nucléaire (IRM).
L’interrogatoire, un temps essentiel
Il apprécie d’abord les antécédents familiaux en recherchant chez les apparentés des cas de cardiomyopathie ou d’insuffisance cardiaque, de myopathies, mais aussi des antécédents précoces de mort subite ou d’implantation de stimulateur cardiaque.
Si nécessaire, un arbre généalogique est construit, de façon à déterminer la part génétique de la maladie et approcher son mode de transmission.
Il s’intéresse ensuite aux antécédents personnels du patient, récents (grossesse, myocardite, etc.) ou plus anciens (chimiothérapie, radiothérapie médiastinale, dysthyroïdie, myopathie, maladie de surcharge, etc.). Quand le patient a été mis en confiance, il porte sur le mode de vie, la consommation d’alcool en appréciant sa quantité et sa durée, les prises de toxiques, etc. Enfin, il recherche des signes fonctionnels pouvant orienter vers une maladie spécifique (myalgies, faiblesse musculaire, arthralgies, etc.).
Un examen clinique complet
Il recherche en particulier : des complications d’un éthylisme, hépatomégalie à bord tranchant, angiomes stellaires, de stigmates de maladies musculaires ou tendineuses, anomalies musculaires comme une hypotrophie, trouble de la marche, des signes évoquant une amylose, macroglossie, infiltration du deltoïde, purpura des paupières dans l’amylose à immunoglobuline, polyneuropathie dans l’amylose à la transthyrétine. L’électrocardiogramme recherche un trouble conductif auriculo-ventriculaire, pouvant orienter vers certains types de forme familiale, un trouble du rythme supraventriculaire, pouvant suggérer l’existence d’une cardiomyopathie rythmique, un microvoltage, fréquent dans certaines maladies de surcharge. Quant au cliché thoracique il n’apportera qu’exceptionnellement un élément spécifique.
Bilan biologique
Il comporte systématiquement un bilan inflammatoire, VS, CRP, une numération de la formule sanguine avec comptage des éosinophiles, une hyperéosinophilie orientant vers une myocardite à éosinophile, un dosage des CPK, élevées dans certaines formes génétiques, de la vitamine B1, de la TSH, de la calcémie, du fer sérique et de la ferritine.
En fonction des données de l’interrogatoire et de la clinique, il sera complété par un bilan auto-immun, notamment si l’on suspecte un lupus érythémateux disséminé, et des sérologies infectieuses, qui ne doivent pas être systématiques et exhaustives mais orientées, à la recherche notamment d’une infection chronique active nécessitant un traitement spécifique ; dans le cas où la CMD apparaît de manière subaiguë dans les suites d’une myocardite, le bilan sérologique doit alors être complet, les titres d’anticorps nettement élevés ou la présence d’IgM signant une infection récente.
Un bilan endocrinien et/ou nutritionnel, pouvant comporter le dosage de la pré-albumine, du sélénium, de la carnitine peut également être nécessaire. En cas de suspicion de Béri-Béri, qui se manifeste le plus souvent par une insuffisance cardiaque biventriculaire à haut débit associée à une polynévrite, le dosage de la vitamine B1 (thiamine N66-200) sera complété par celui de l’activité transcétolasique érythrocytaire qui sera alors diminuée. En cas de suspicion d’amylose à immunoglobuline, l’immunoélectrophorèse des protéiques sériques et urinaires sera complétée par un dosage sanguin direct des chaînes d’immunoglobuline en cause, kappa ou lambda. Si une amylose à la transthyrétine est suspectée, notamment en cas d’antécédents familiaux ou devant une atteinte nerveuse périphérique, la recherche de la mutation de ce gène est demandée.
Bilan génétique
Réalisé à partir d’un simple prélèvement sanguin, il n’est prescrit qu’en présence d’une atteinte familiale connue ou retrouvée à l’interrogatoire. La recherche peut porter sur les gènes connus ou sur de nouveaux gènes en fonction du nombre de sujets atteints dans une même famille. Les gènes et les mutations impliqués étant très variables d’une famille à l’autre, le rendement de l’analyse génétique est faible, une mutation n’étant retrouvée que dans moins de 20 % des formes familiales. Le gène de la chaîne lourde de la ß myosine est le plus intéressant à tester. Ainsi, la réalisation technique étant difficile, le coût élevé et l’apport discutable, le diagnostic d’une cardiomyopathie génétique ne nécessitant habituellement pas de preuve moléculaire, ce bilan génétique n’est encore que rarement réalisé. De plus, la mise en évidence d’une mutation n’implique pas obligatoirement sa responsabilité, du moins exclusive, dans la genèse de la CMD. Cependant, dans les formes familiales ou sporadiques présentant un phénotype particulier, comme un trouble conductif, il est intéressant de rechercher une mutation de certains gènes, comme celui de la lamine, dont la mise en évidence peut modifier la stratégie thérapeutique.
Bilan d’imagerie
L’échocardiographie-Doppler n’oriente que rarement vers une étiologie secondaire comme une non-compaction du ventricule gauche ou une amylose.
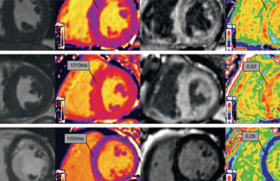
L’IRM de contraste, avec injection de gadolinium, en permettant une caractérisation tissulaire, est l’examen morphologique le plus contributif dans le cadre du bilan étiologique d’une CMD. Il peut retrouver :
• les séquelles d’un infarctus du myocarde, sous la forme d’une accumulation de gadolinium transmurale ou sous-endocardique localisée au sein d’un territoire coronaire. Il s’agit alors d’une cardiopathie ischémique à coronaires angiographiquement normales, situation non exceptionnelle, amenant à la recherche d’une origine cardio-embolique, cause d’une occlusion coronaire transitoire, ou d’une maladie athéromateuse infra-radiologique à l’origine d’une rupture de plaque. Seront alors réalisés un enregistrement ECG-Holter cherchant à mettre en évidence une fibrillation atriale paroxystique, une échocardiographie transœsophagienne à la recherche d’un thrombus intracavitaire, un bilan d’hémostase pour éliminer une coagulopathie et éventuellement une échographie endocoronaire. En cas d’anomalie de ces examens, un traitement anticoagulant par anti-vitamines K ou antiathérothrombotiques par antiagrégants plaquettaires et statines pourra être indiqué ;
• les séquelles fibreuses d’une myocardite, sous la forme d’un rehaussement nodulaire ou en bande sous-épicardique. En fonction du contexte clinique, elle pourra alors guider le lieu de réalisation d’une biopsie myocardique ;
• les stigmates d’une maladie de surcharge, hémochromatose ou amylose, avec dans ce dernier cas un aspect de rehaussement tardif sous-endocardique circonférentiel ;
• les logettes d’une non-compaction du ventricule gauche ;
• des plages de fibrose spécifiques qui, si elles n’orientent pas le diagnostic étiologique, constituent un élément pronostique.
Biopsie myocardique
Elle n’est que rarement réalisée en dehors de certains centres spécialisés.
Elle est indiquée en cas d’insuffisance cardiaque de cause inconnue, dont l’apparition est récente, soit < 15 jours et ne répondant pas au traitement, soit < 3 mois et associée à un trouble conductif, à la recherche d’une myocardite. Elle n’est pas dénuée de risque, le plus sévère étant la perforation cardiaque pouvant se compliquer de tamponnade, et implique un laboratoire d’anatomo-pathologie performant en pathologies cardiaques.
Elle peut mettre en évidence, le plus souvent dans les formes subaiguës, une participation inflammatoire, pouvant orienter vers un traitement spécifique comme la myocardite à cellules géantes et la myocardite à éosinophile. Dans certaines séries, des processus inflammatoires myocardiques sont ainsi retrouvés chez 40 à 50 % des patients. La recherche du génome viral est également possible, focalisée sur les virus cardiotropes comme les entérovirus, les adénovirus, les parvovirus et l’herpès virus. La persistance au niveau du myocarde du génome des entérovirus ou des adénovirus est retrouvée selon les séries chez 5 à 15 % des patients présentant une CMD. Elle peut également permettre le diagnostic de formes secondaires, comme une amylose, en cas d’atteinte cardiaque isolée. Son développement permettrait une amélioration du diagnostic étiologique des CMD.
Prise en charge thérapeutique
L’évolution clinique sous traitement spécifique confirmera parfois le diagnostic étiologique a posteriori, comme c’est le cas pour les cardiomyopathies rythmiques, dont le diagnostic requiert une récupération totale de la fonction systolique après retour et maintien du rythme sinusal, et de la cardiomyopathie alcoolique, où le sevrage doit conduire à une normalisation de l’état ventriculaire gauche, pour confirmer le rôle causal de l’éthylisme.
La mise en évidence d’une étiologie devant une CMD peut permettre de proposer un traitement spécifique. Un traitement immunosuppresseur est indiqué dans les myocardites à cellules géantes, les myocardites à éosinophile et dans les CMD compliquant une maladie de système, alors qu’il est délétère au cours des myocardites virales. Un traitement par immunoabsorption a été proposé au cours des CMD en insuffisance cardiaque sévère présentant des auto-anticorps « anti-cœur », notamment dirigés contre les b-1 récepteurs adrénergiques, avec des résultats qui méritent d’être confirmés notamment à long terme.
Dans les cardiomyopathies du péripartum, la bromocriptine, grâce à l’inhibition de la production de prolactine, pourrait prévenir la récidive en cas de nouvelle grossesse et devenir ainsi le traitement de cette maladie, associée aux anticoagulants en raison du risque thromboembolique élevé dans ce type de CMD, que la bromocriptine pourrait majorer.
Au cours des CMD survenant chez les alcooliques, en sus de l’abstinence, une supplémentation vitaminique, notamment en thiamine (vitamine B1), est en règle générale préconisée. Les problèmes de sevrage peuvent nécessiter une prise en charge médicamenteuse ou psychiatrique spécifique.
Quant aux tachycardiomyopathies, leur traitement nécessite fréquemment un recours à l’ablation par radiofréquence, que l’arythmie soit atriale ou ventriculaire, l’emploi des antiarythmiques, en dehors de l’amiodarone, étant rendu délicat par l’altération de la fonction systolique qui majore le risque d’effet pro-arythmogène. Enfin, les CMD compliquant une obésité morbide peuvent être améliorées par l’amaigrissement majeur généré par une chirurgie bariatrique, qui est associé à une diminution des volumes ventriculaires, une augmentation de la fraction d’éjection et une diminution de l’activité neurohormonale, conséquences de l’amélioration de l’hémodynamique et de la diminution des effets directs lipotoxiques de l’obésité.
En pratique
Les progrès constants dans la compréhension et l’exploration des CMD font que ces maladies ne devraient bientôt plus avoir de primitives que le nom. Néanmoins, malgré un bilan étiologique complet, il n’est pas rare, y compris chez les personnes de près de 60 ans, de porter encore le diagnostic de CMD idiopathique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :