Rythmologie et rythmo interventionnelle
Publié le 14 mar 2016Lecture 7 min
Défibrillateur sous-cutané : plus ou moins deux ans
C. MARQUIÉ, Maladies coronaires et cardiologie interventionnelle, CHRU de Lille
JESFC
L’arrivée du défibrillateur automatique implantable sous-cutané (DAI-SC) en France date de début 2013. Qu’avons-nous fait de ces deux ans pour ce qui est de l’innovation la plus importante en termes de défibrillation depuis 20 ans et que pouvons-nous en attendre dans les deux ans qui viennent ?
Rappel sur le matériel
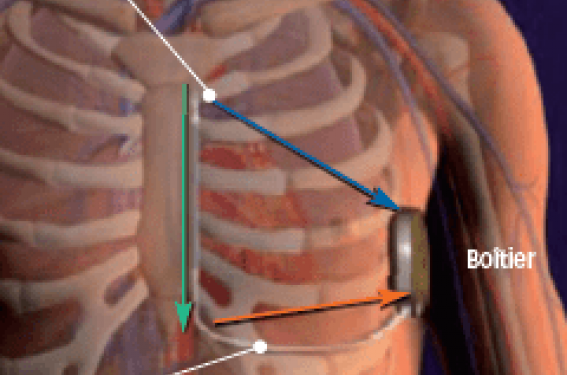
Le DAI-SC est un défibrillateur avec du matériel (boîtier + sonde) en position uniquement sous-cutanée : il n’y a plus de sonde endocavitaire. Il est constitué d’un boîtier, placé en position latéro-thoracique gauche et d’une sonde placée en parasternale (droite ou gauche) et tunnélisée sous la peau (figures 1 et 2).
Figure 1. Schéma illustrant le positionnement sous-cutané du boîtier (+ sonde) qui est placé dans cet exemple en parasternal gauche. Les 3 flèches de couleur représentent les 3 vecteurs possibles pour la détection : Flèche orange : « vecteur primaire » entre l’électrode proximale et le boîtier. Flèche bleue : « vecteur secondaire » entre l’électrode distale et le boîtier. Flèche verte : « vecteur supplémentaire » entre les électrodes proximale et distale.
Figure 2. Radiographie de thorax d’un patient implanté d’un DAI sous-cutané.
L’innovation majeure est le principe du « tout sous-cutané », ce qui sous-entend une détection sous-cutanée et une défibrillation sous-cutanée.
La détection se fait selon un dipôle constitué d’une électrode placée sur la sonde et le boîtier ou entre les deux électrodes de la sonde (figure 1).
La thérapie consiste uniquement en la délivrance de chocs à énergie unique et non programmable de 80 joules. Il n’y a pas de stimulation antitachycardique ou de fonction pacemaker sur ce type d’appareil.
Rappelons que le premier modèle implanté était le CAMERON, remplacé par la seconde génération (février 2015 en France) l’EMBLEM (figure 3).
Le tableau 1 compare rapidement les caractéristiques principales des DAI-SC par rapport aux défibrillateurs endocavitaires conventionnels.
Figure 3. Caractéristiques des boîtiers Cameron et Emblem.
Les acquis 2 ans après les débuts en France
Les premières implantations chez l’homme ont été effectuées en 2008. À ce jour, 12 000 patients ont été implantés dans le monde, 685 patients en France dont 465 pour l’année 2015.
• Concernant la sécurité, les différentes études cliniques publiées montrent un taux d’efficacité sur les événements ventriculaires spontanés de plus de 98 %(1-3).
• Concernant l’éligibilité des patients, environ 8 % des patients (16 % dans les CMH) ne passent pas le screening cutané préimplantation : il s’agit d’un tracé ECG à réaliser avant l’implantation pour s’assurer d’une détection correcte une fois que l’appareil sera implanté(4,5). Par ailleurs, il n’est pas raisonnable d’implanter à ce jour des patients de moins de 30 kg pour des raisons techniques.
Cette technique ne s’adresse pas non plus aux patients ayant besoin d’une fonction pacemaker ou d’une resynchronisation.
Hormis ces situations, tout patient est potentiellement éligible à un DAI-SC. Celui-ci est d’ailleurs rentré dans les recommandations internationales en 2015 comme une alternative au défibrillateur endocavitaire chez des patients n’ayant pas d’indication de pacemaker, de resynchronisation ou de stimulation antitachycardique (IIaC)(6).
• Pour ce qui est des complications, dans le pool data analysis (plus grosse série publiée à ce jour sur les DAI-SC), le taux d’infection est de 3,5 %(3). Il n’y a aucune endocardite bien entendu (pas de matériel endocavitaire). Par ailleurs, sur ces 3,5% d’infection, il n’a été nécessaire d’extraire le matériel que chez 1,7 % des patients pour guérir l’infection. La position sous-cutanée du matériel rend a priori plus accessible les infections à une prise en charge non invasive.
La complication qui reste à surveiller reste aujourd’hui le taux de thérapie inappropriée, 13 % à 3 ans dans le pool data. Cependant, on peut noter dans ce travail une nette diminution des thérapies inappropriées dans le dernier quartile des patients qui avoisine plutôt les 7 % (nouveaux algorithmes de détection onde T, meilleure expérience des cliniciens pour le réglage de l’appareil, réalisation d’épreuves d’effort…).
Par ailleurs, à ce jour aucune fracture de sonde n’a été documentée. Cela s’explique vraisemblablement par une sonde plus robuste (sonde pleine et plus grosse).
Technique d’implantation : le matériel étant entièrement sous-cutané, il n’est pas difficile à mettre en place. Cependant il ne s’agit pas du tout de la même technique que les appareils endocavitaires ni de la même zone opératoire. Dans ces conditions, il existe une courbe d’apprentissage rapide mais nécessaire(7). Cette implantation demande une grande rigueur concernant la position de la sonde et du boîtier : en effet, de la position du matériel dépend une détection et une défibrillation correctes.
L’implantation de ce matériel nécessite moins de 20 secondes de scopie juste avant l’implantation pour parfaire le positionnement de la sonde et du boîtier. Toute la procédure peut se dérouler sans rayon X.
En France aujourd’hui on implante ce matériel quasi exclusivement sous anesthésie générale (au regard de la grande surface à anesthésier et en raison du test de défibrillation en fin de procédure). Quelques centres commencent à implanter sous AL avec une AG de courte durée en fin de bloc pour tester le défibrillateur (AG courte comme pour une cardioversion de FA) mais cette technique reste à valider.
Le tableau 1 synthétise les différences entre les 2 types d’appareil endocavitaire et sous-cutané.
Qu’attendre des deux ans à venir ?
• Une nouvelle sonde avec quelques modifications (olive intégrée).
• Étendre l’accès à la télésurveillance : celle-ci est arrivée courant du second semestre 2015 sur les modèles EMBLEM. Il faudra valider son intérêt pour ce type de défibrillateur et l’étendre à tous les centres.
• La réponse concernant l’IRMcompatibilité des modèles actuels ou des générations à venir. À ce jour le défibrillateur que nous implantons n’est pas IRM-compatible.
• Surveiller dans les études cliniques le taux de thérapies inappropriées et le ratio thérapies inappropriées/thérapies appropriées. Ce point a déjà été soulevé dans cet article. Deux études très importantes sont en cours. Le registre EFFORTLESS dont les premiers résultats ont été publiés mais qui continue à inclure des patients (objectif : 1 000 patients)(2) ; et l’étude randomisée PRAETORIAN comparant le S-ICD au défibrillateur endocavitaire classique : les inclusions sont presque terminées(8). Ce sera la première étude randomisée comparant les deux types de défibrillateur.
• Le registre français du S-ICD vient de débuter sous l’égide de la SFC. L’analyse des données sera importante pour avoir une photographie du S-ICD en France et des données de suivi des patients.
• Enfin, pour en finir avec les études cliniques, les États-Unis ont commencé les implantations en 2015 à tambour battant : gageons que nous aurons également de ce côté-là de l’Atlantique des données cliniques conséquentes et intéressantes.
• Les travaux en cours sont nombreux et les publications vont se multiplier, amenant des données sur les patients et les situations spécifiques dans lesquelles l’appareil est implanté (cardiopathie congénitale, syndrome de Brugada…)(9).
• Durée de vie réelle des boîtiers : en Europe, les boîtiers implantés plus précocement ont tenu leur promesse initiale de durée de vie. En France, les premiers implantés semblent suivre cette tendance.
• Solidité de la sonde : à ce jour aucune fracture de sonde n’a été décrite, mais nous n’avons pas encore assez de recul. Il faudra bien entendu surveiller la durée de vie des sondes, surtout après changement de boîtier et la capacité de les extraire et les réimplanter en cas de problème.
• Un appareil 3e génération avec des fonctions holter : à ce jour les données holter de l’appareil sont quasi inexistantes. L’appareil ne stocke que les informations sur les événements traités ou avec charge des condensateurs. Aucune information sur les épisodes non soutenus, la fréquence cardiaque, pas de zone holter.
La question essentielle reste aujourd’hui : à quels patients implanter ce type d’appareil ?
De manière évidente cet appareil est la solution idéale chez les patients à accès veineux difficile ou impossible (cardiopathie congénitale, thrombose des axes veineux) chez les patients infectés (infection chronique, antécédent d’infection sur matériel implantable, cathéter centraux à demeure, etc.).
Cet appareil est avant tout « une boîte à chocs » robuste. Elle s’adresse donc en premier lieu aux patients à risque de fibrillation ventriculaire et jeunes (car plus à risque de rupture de sonde en cas d’implantation d’un appareil endocavitaire). Dans cette catégorie on trouve donc les patients ayant fait une fibrillation ventriculaire idiopathique, ou à risque de FV (syndrome de Brugada, CMH, QT long, etc.).
Aujourd’hui ces patients représentent une partie des patients implantés d’un S-ICD.
Mais la vraie question demeure : faut-il implanter les patients à FE basse en prévention primaire (MADIT 2 et cardiomyopathie dilatée à FE basse) ?
La discussion qui anime les rythmologues actuellement est de savoir s’il vaut mieux implanter un DAI-SC et se passer de la stimulation antitachycardique et de la fonction pacemaker, ou implanter un endocavitaire et prendre les risques de rupture de sonde et d’endocardite.
Sachant également que nous avons un recul modéré sur le S-ICD et qu’aujourd’hui nous ne sommes vraisemblablement pas capables de prévoir tous les événements et que a contrario nous connaissons bien les avantages et les limites du matériel endocavitaire pour lequel nous avons 30 ans de recul.
Alors S-ICD ou endocavitaire ?
Chacun fait pencher la balance en fonction de l’âge du patient, de la cardiopathie, des tares associées du patient, de son expérience, du désir et du morphotype du patient…
Les tableaux 1 et 2 résument les différences entre les deux types de défibrillateurs et les points forts et les points faibles de l’appareil sous-cutané.
En pratique
Il est indéniable que le DAI-SC apporte aujourd’hui de nouvelles perspectives à la défibrillation. Il est dès aujourd’hui le défibrillateur idéal dans un certain nombre de situations.
Pour les autres, il est certain que l’avenir apportera des solutions techniques à ce qui lui manque aujourd’hui comme la stimulation antitachycardique et les fonctions pacemaker (couplage avec un pacemaker sans sonde ?) ou une taille moindre et une durée de vie plus longue.
Enfin, les études cliniques et les registres viendront préciser la place optimale à donner à cet appareil dans notre pratique clinique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :