Congrès et symposiums
Publié le 14 oct 2014Lecture 13 min
Pathologie valvulaire cardiaque : le TAVI toujours en tête
J.-L. MONIN, CHU Henri Mondor, Créteil
ESC
Cette année encore, pas de scoop majeur dans le domaine des valvulopathies. Sans surprise, l’évaluation des prothèses transcathéter (TAVI) domine très largement la sélection d’abstracts et même les sessions plénières. Chaque pays ayant son registre sur le TAVI, les données s’accumulent et permettent d’évaluer la technique sous tous ses angles : sélection des patients et place de l’imagerie, fuites périprothétiques, taux d’implantation de pacemaker et enfin élargissement des indications vers les patients à faible risque opératoire. À part le TAVI ? Beaucoup de sessions sur la sténose aortique qui reste la valvulopathie n°1 et sur l’insuffisance mitrale. Comme chaque année, j’ai sélectionné une quinzaine d’études qui peuvent avoir un intérêt assez direct pour notre pratique quotidienne.
Évaluer la fragilité et l’invalidité avant remplacement valvulaire ou TAVI
Première étude italienne(1) évaluant la prévalence et l’impact pronostique de la fragilité avant replacement valvulaire aortique (RVA) ou implantation d’une bioprothèse aortique transcathéter (TAVI) sur une série de 191 patients à risque opératoire relativement élevé : âge > 80 ans ou EuroSCORE I (logistique) > 20 %. Les patients étaient considérés comme fragiles en cas de présence d’au moins 2 items parmi les suivants :
- IMC < 20 kg/m2 ;
- albumine sérique < 3,5 g/dl ;
- Mini Mental Score < 24/30 ;
- incontinence urinaire ou fécale, dépendance pour les activités quotidiennes (se laver, se nourrir, etc.) ou dépendance totale pour les transports.
Noter au passage que les 2 derniers items entrent plutôt dans le cadre de l’invalidité. Le profil de risque des patients opérés (n = 79) était plus favorable que dans le groupe TAVI (n = 112) : âge = 80 ± 4 vs 82 ± 6 ans (p = 0,01) ; EuroSCORE plus faible : 12,3 ± 6,3 % vs 22,1 ± 13,3 % (p < 0,001) et classe NYHA III/IV moins fréquente : 43,9 % vs 87,5 % (p < 0,001). Moins de patients fragiles également dans le groupe chirurgical : 3,0 % vs 26,8 % dans le groupe TAVI (p < 0,001). Finalement, la fragilité est un facteur pronostique indépendant de mortalité périprocédure (AVR ou TAVI : risque relatif de décès = 2,7, IC95 % : 1,5-4,9, p < 0,001) y compris après ajustement sur l’EuroSCORE. Les auteurs concluent que l’évaluation de la fragilité est importante puisqu’elle apporte des éléments supplémentaires par rapport aux scores de risque (qui évaluent surtout les comorbidités). En cas de fragilité extrême, toute procédure invasive (TAVI inclus) peut se révéler futile, sans bénéfice à moyen terme pour le patient.
Plusieurs autres études ont confirmé ces résultats, dont une étude espagnole(2) concernant 438 patients de plus de 75 ans ayant un rétrécissement aortique calcifié (RAC) sévère et suivis de manière prospective : âge moyen = 83 ± 4,7 ans et 58,2 % de femmes, principaux symptômes : dyspnée classe IIIIV NYHA dans 35 % et angor classe CCS III-IV dans 11,5 % des cas. Des critères de fragilité étaient retrouvés chez 44,1 % des patients, plus fréquemment chez les femmes (71 %). Une fois de plus, la fragilité influence de manière déterminante la mortalité à moyen terme : un an et demi après l’intervention, la mortalité est de 13 % (fragile) vs 8 % (non fragile, p < 0,001) après RVA et de 45 % vs 12 % (p < 0,001) après TAVI. Ici encore, l’impact pronostique de la fragilité est indépendant des facteurs de comorbidité (âge, classe NYHA, maladie coronaire, insuffisance rénale, etc.) et multiplie par 2 le risque de décès après intervention.
En résumé, un nombre croissant d’études démontre l’importance d’évaluer la fragilité et la dépendance, en plus des comorbidités avant de décider d’une intervention cardiaque, notamment remplacement valvulaire aortique ou TAVI.
La fragilité est définie comme une vulnérabilité au stress, liée à une faiblesse générale ou la défaillance de plusieurs organes ; elle est à distinguer de l’invalidité qui entraîne une perte d’autonomie pour les tâches de la vie courante et des comorbidités (insuffisance respiratoire, insuffisance rénale, etc.).
En pratique, comment évaluer nos patients ? Une étude récente(3), dont le but était de tester les meilleurs échelles d’évaluation, donne un résultat intéressant : la fragilité peut être évaluée de manière très simple par un test de rapidité à la marche de 5 mètres (encadré 1) et l’invalidité par l’échelle de Nagi (encadré 2). En plus d’un score de risque opératoire qui reste indispensable (score STSPROM de préférence à l’Euro-SCORE), ces 2 échelles permettent d’avoir une évaluation plus globale du patient afin de mieux évaluer le rapport bénéfice/risque avant une intervention valvulaire aortique. Dans tous les cas, la décision d’intervention doit être validée de manière collégiale par un staff multidisciplinaire (Heart Team) composé de cardiologues cliniciens et interventionnels, chirurgiens cardiaques, anesthésistes, gériatres ou toute autre spécialité en fonction des cas individuels (cf. recommandations ESCEACTS 2012 et AHA-ACC 2014 sur la prise en charge des maladies valvulaires).
Rétrécissement aortique (I) : critères de sévérité discordants
Faut-il modifier certaines valeurs seuils dans les recommandations afin d’harmoniser les critères de sévérité du RAC ? Une équipe allemande(4) continue d’exploiter la mine de données de l’étude SEAS (Simvastatin and Ezetimibe in Aortic Stenosis). Il a été démontré que la prévalence de RAC sévères au sein d’une même population peut varier de 40 à 76 % en fonction du critère de sévérité considéré (tableau 1). De plus, la correspondance entre une surface aortique brute de 1,0 cm2 et une surface indexée à 0,6 cm2/m2 présuppose une surface corporelle moyenne de 1,67 m2, ce qui est au-dessous des moyennes actuelles. Partant de cela, les auteurs ont évalué le taux d’événements cardiaques indésirables survenus parmi les 1 525 patients (initialement asymptomatiques) de l’étude SEAS en fonction des quintiles de surface valvulaire aortique brute et indexée à la surface corporelle. Il s’avère que dans le quintile des RAC les plus sévères, la surface aortique moyenne était de 0,7 ± 0,1 cm2, correspondant à une surface indexée de 0,4 cm2/m2 (surface corporelle moyenne dans l’étude SEAS : 1,89 m2) et un taux d’événements à 5 ans de 50 %. Dans le second quintile, la surface aortique moyenne était de 1,0 ± 0,1 cm2, correspondant à une surface indexée de 0,5 ± 0,1 cm2/m2 et un taux d’événements de 40 %.
Les auteurs concluent qu’il serait logique de ramener le seuil de sévérité à 0,5 cm2/m2 pour la surface aortique indexée. Rappelons que cette valeur de 0,5 cm2/m2 était celle proposée dans les recommandations françaises (SFC) de 2005(5).
Rétrécissement aortique (II) : calcification valvulaire/bas débit paradoxal
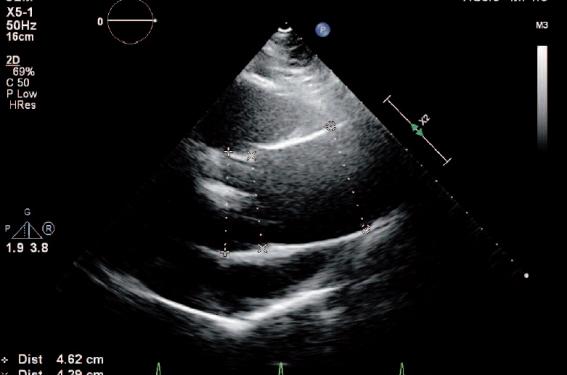
Le degré de calcification valvulaire est un des facteurs pronostiques majeurs dans le RAC. Une étude multicentrique coordonnée par l’équipe de Bichat(6) a évalué de manière prospective 295 patients ayant un RAC modéré à sévère. La sévérité hémodynamique était quantifiée par échographie Doppler et le score calcique valvulaire calculé à partir d’un scanner sans injection. Malgré une bonne corrélation entre le gradient moyen transvalvulaire et le score calcique (r = 0,70 ; p < 0,0001), le score calcique était en moyenne plus élevé en cas de bicuspidie (figure 1) par rapport aux valves à 3 sigmoïdes et chez les hommes par rapport aux femmes, à sévérité hémodynamique comparable. Par ailleurs, la rapidité de progression des calcifications valvulaires était fortement influencée par le degré de sévérité hémodynamique initiale (gradient moyen). En d’autres termes, pour une même sévérité hémodynamique, le degré de calcification valvulaire aortique est déterminé par le sexe (masculin) et l’étiologie (bicuspidie) ; en fin d’évolution, plus le RAC est sévère et plus les calcifications progressent rapidement. Ceci est un argument pour penser qu’un traitement efficace sur le processus de calcification valvulaire pourrait être utile à tous les stades de la maladie, y compris en cas de RAC sévère.
Figure 1. Échographie transthoracique/zoom sur une vue parasternale transverse. Rétrécissement aortique calcifié sur bicuspidie de forme commune : raphé calcifié (flèches) situé entre les 2 sigmoïdes coronaires droite (D) et gauche (G). N : sigmoïde non coronaire. À degré de sévérité comparable, le score calcique est plus élevé en cas de bicuspidie par rapport aux valves à 3 sigmoïdes (cf. Abstract 2390).
Bas débit paradoxal : on en reparle avec une étude du groupe de l’université Saint-Luc à Bruxelles(7) qui a suivi de manière prospective 105 patients consécutifs ayant un profil hémodynamique compatible avec un RAC en bas débit paradoxal (surface aortique indexée < 0,6 cm2/m2 avec gradient moyen < 40 mmHg malgré une fraction d’éjection VG > 50 %). Pour l’ensemble du groupe, au cours d’un suivi moyen de 21 mois, le gradient moyen transvalvulaire a progressé de 29 ± 6 mmHg à 38 ± 11 mmHg (p < 0,001). In fine, 45 % des patients avaient dépassé 40 mmHg de gradient moyen et donc basculé dans la catégorie « haut gradient » ; 37 % gardaient un gradient moyen < 40 mmHg mais avec une progression significative (de 26 ± 5 mmHg à 32 ± 5 mmHg ; p < 0,001) et seuls 18 % des patients ont vu leur gradient moyen stagner ou diminuer avec dans le même temps une dégradation de leur fraction d’éjection dans 11 cas/18. Les auteurs concluent que la plupart des patients ayant un profil de bas gradient « paradoxal » évoluent en fait vers le profil « classique » avec haut gradient transvalvulaire. Le bas gradient « paradoxal » serait donc une forme transitoire, moins évoluée que le RAC à haut gradient, et non un stade plus évolué de la maladie comme suggéré par d’autres équipes.
Rétrécissement aortique (III) : prévalence et vieillissement de la population
Une étude très intéressante(8) a évalué la prévalence de RAC « sévères » sur un échantillon de 8 030 individus, représentatif de la population générale islandaise (AGES-Reykjavik study). D’après les échocardiographies de 685 individus (âge moyen = 76 ± 6 ans, 58 % de femmes) un RAC sévère était défini par un critère unique et peu spécifique (tableau 2) : la surface aortique indexée < 0,6 cm2/m2. Pour le score calcique, le seuil de sévérité de 500 UA (relativement faible) a ensuite été déterminé par courbes de ROC, par rapport à l’échographie. Il n’est pas étonnant de constater que la prévalence de RAC significatif augmente avec l’âge : de 0,8 à 0,9 % avant 70 ans à 7 % (échographie) voire 9,5 % (score calcique). Ces chiffres de prévalence sont légèrement au-dessus des chiffres habituels (3-4 % de RAC sévères après 75 ans), probablement du fait de critères diagnostiques très sensibles et peu spécifiques. Plus intéressant : en effectuant une projection basée sur le vieillissement progressif de la population en Islande, le nombre de RAC sévères (sujets > 70 ans) devrait doubler entre 2012 et 2035, voire tripler d’ici 2060. Cette étude n’est pas la seule à aboutir à cette conclusion parfaitement cohérente avec le vieillissement de nos populations occidentales. Pour mémoire, on estime le nombre de nouveaux cas de RAC sévères autour de 200 000 par an en France actuellement. Il n’est donc pas exagéré de considérer le RAC comme un enjeu majeur de santé publique.
Insuffisance mitrale : échographie d’effort et dosage du BNP
L’échographie d’effort peine à se faire une place dans l’insuffisance mitrale (IM) asymptomatique, avec le niveau de recommandation le plus faible pour l’ESC (classe IIb) voire une absence remarquée dans les récentes recommandations ACC-AHA 2014. L’équipe d’Amiens(9) a coordonné une étude bicentrique avec le CHU de Lille afin d’évaluer la faisabilité de cet examen. L’échographie d’effort a donc été pratiquée chez 72 patients non sélectionnés (âge 59 ± 15 ans, 62 % d’hommes) ayant une IM primitive ou secondaire de grade ≥ 3/4 : surface d’orifice régurgitant (SOR) = 36 ± 14 mm2. En pratique, la fraction d’éjection VG a pu être évaluée visuellement au repos et à l’effort chez 100 % des patients. Les pressions pulmonaires ont pu être évaluées au repos et au pic de l’effort chez respectivement 100 % et 83 % des patients. Le calcul de la SOR par la méthode de la PISA est moins faisable en position semi-assise (76 % des cas ; 74 % en cas de prolapsus) par rapport au décubitus latéral gauche (92 %, p = 0,012). Le calcul de la SOR à l’effort est encore plus aléatoire, obtenu seulement chez 30/55 patients (55 %), notablement plus difficile en cas de prolapsus par rapport aux IM rhumatismales ou secondaires (respectivement dans 43 %, 67 % et 88 % des cas, p = 0,05). Enfin, quelle que soit l’étiologie de l’IM, on observe une augmentation significative de la SOR dans la plupart des cas (70 %), en moyenne de +10 ± 5 mm2.
Les auteurs concluent que la faisabilité du calcul de la SOR à l’effort est techniquement difficile, notamment en cas d’IM par prolapsus ; le monitoring pendant l’effort des pressions pulmonaires et l’estimation visuelle de la FEVG semblent plus accessibles en pratique courante.
Deuxième étude bicentrique Mayo Clinic, Rochester USA/ CHU d’Amiens(10) : le taux de BNP sérique a été mesuré en même temps que les données échographiques chez 1 015 patients (âge : 65 ± 15 ans, FEVG : 63 ± 9 %) ayant une IM par prolapsus. Un BNP ratio était calculé pour chaque patient : rapport entre BNP mesuré et valeur normale compte fonction de l’âge et du sexe. Pour l’ensemble de la cohorte, le taux de BNP moyen était de 103 pg/ml (quartiles : 39-285) et le BNP ratio de 1,2 (0,5-2,8). Après ajustement sur l’ensemble des variables pertinentes (âge, sexe, score de Charlson, fonction rénale, FEVG et chirurgie valvulaire), le BNP ratio est un facteur prédictif de mortalité très puissant (RR : 1,42 [1,22- 1,66] ; p < 0,0001) avec augmentation progressive du risque de mortalité à long terme, proportionnellement au BNP ratio. Les auteurs suggèrent que ce paramètre soit considéré dans la prise en charge des patients asymptomatiques ayant une IM primitive sévère. Rappelons que l’équipe de la Mayo Clinic avait présenté une étude très proche sur le BNP ratio dans le RAC à l’ESC 2013 (cf. Cardiologie Pratique n°1049), publiée depuis dans le JACC(11).
Bicuspidie : dilatation progressive de la racine aortique/intérêt du dépistage familial
Une équipe canadienne(12) a comparé la progression de la dilatation aortique (mesures échographiques, figure 2) en cas de RAC sur bicuspidie (n = 258) ou RAC sans bicuspidie (n = 5 843). Chaque groupe était divisé en 3 catégories en fonction de la sévérité hémodynamique du RAC, évaluée sur le gradient moyen transvalvulaire. Les résultats montrent que la dilatation de la racine aortique débute au stade de RAC modéré et qu’il n’y a pas de différence significative dans la vitesse de progression entre les 2 groupes (tableau 2). En conclusion, la progression de la dilatation aortique n’est pas plus rapide en cas de RAC sur bicuspidie mais la taille de l’aorte est constamment supérieure par rapport aux RAC sans bicuspidie, à cause d’un diamètre initial plus large.
Figure 2. Échographie transthoracique/incidence parasternale longitudinale haute. Dilatation de la racine aortique, les mesures échographiques sont effectuées en diastole, de bord d’attaque à bord d’attaque aux 3 niveaux : 1 : sinus de Valsalva ; 2 : jonction sino-tubulaire et 3 : portion tubulaire (aorte ascendante) (cf. Abstract 2109).
L’équipe de l’Hôpital Vall d’Hebron à Barcelone(13) a évalué la reproductibilité des mesures de diamètre aortique par échographie, scanner ou IRM cardiaque sur 100 patients consécutifs (âge moyen : 55 ± 11 ans ; 54 % d’hommes). Globalement, la reproductibilité des mesures est bonnes pour les 3 techniques avec un léger avantage pour le scanner, ce qui ne doit pas empêcher de privilégier les techniques non irradiantes (échographie et IRM) dans tous les cas, notamment chez les sujets jeunes (cf. recommandations ESC et ACCAHA). Cependant, il est important de noter que dans les meilleures conditions d’analyse, la variabilité interobservateur est de 1,5 à 2,5 mm avec 15 % de variabilité > 2 mm en échographie et IRM et 20 % au scanner. En d’autres termes, le seuil de 2 mm d’augmentation du diamètre aortique en 1 an proposé par l’ESC comme critère de chirurgie aortique semble discutable, puisqu’il est très proche de la variabilité de la mesure. Le seuil de 5 mm proposé dans les Guidelines ACC-AHA-2014 semble plus raisonnable.
Le dépistage familial est-il justifié en cas de bicuspidie ? La même équipe(14) a dépisté les apparentés au 1er degré de 90 patients ayant une bicuspidie. Sur 401 sujets contactés, 288 (72 %) ont accepté l’échocardiographie de dépistage (âge moyen : 36 ± 19 ans, 67 % d’hommes). Une bicuspidie a été détectée chez 20 apparentés, plus une quadricuspidie chez un dernier sujet, d’où une prévalence de formes familiales de 19 %. La prévalence de bicuspidie en cas d’apparenté au 1er degré est de 7,3 %, nettement supérieure à celle de la population générale (0,5 à 1 %). Il suffit d’examiner 14 sujets apparentés au 1er degré pour diagnostiquer une bicuspidie (contre 100 dans la population générale). Ces résultats sont donc en faveur du dépistage chez les sujets apparentés, au moins en termes de rentabilité diagnostique.
TAVI : comparaison avec la chirurgie/Valve in Valve/sur valve bicuspide
Parmi les dizaines d’études sur le TAVI présentées à l’ESC cette année, trois ont particulièrement retenu mon attention. À partir du registre italien OBSERVANT(15), 2 groupes de 650 patients (un groupe TAVI et un groupe remplacement valvulaire chirurgical, CHIR) strictement comparables en termes de caractéristiques démographiques, données hémodynamiques et profil de risque ont été évalués. La particularité de cette étude est qu’elle s’adresse à des patients dont le risque opératoire est minime à modéré : EuroSCORE logistique : 10 ± 9 % (CHIR) vs 9 ± 7 % (TAVI, p = NS). Sans surprise, les résultats montrent un peu plus d’insuffisance rénale après chirurgie et plus de complications d’abord vasculaire et d’implantations de pacemakers après TAVI. Finalement, la mortalité est strictement comparable dans les 2 groupes en postopératoire : 3,8 % (CHIR) vs 3,2 % (TAVI, p = NS) et à 6 mois : 10,4 % (CHIR) vs 8,8 % (TAVI, p = NS). Cette étude est intéressante car elle démontre les excellents résultats du TAVI chez les patients à faible risque opératoire, ce qui laisse entrevoir un élargissement prochain (et inéluctable) des indications…
Les procédures « Valve in Valve », soit l’implantation d’une prothèse transcathéter dans une bioprothèse dégénérée, ont été évaluées dans le cadre du registre France 2(16). Parmi les 3 761 patients consécutifs du registre, 64 procédures « Valve in Valve » réparties équitablement entre la prothèse Medtronic CoreValve (52 %) et la prothèse Edwards SAPIEN (48 %). Par rapport à l’ensemble du registre, ces 64 patients étaient plus jeunes, plus symptomatiques (85 % en classe NYHA III-IV) et avec un EuroSCORE plus élevé (34 ± 18 % vs 22 ± 14 % ; p < 0,001). Malgré cela, les résultats des procédures « Valve in Valve » étaient comparables à l’ensemble de la cohorte de France 2 en termes de survie et d’amélioration fonctionnelle (90 % en classe NYHA I-II) à 1 an. Ces résultats sont donc en faveur d’un développement des indications de TAVI « Valve in Valve » en cas de réintervention jugée à haut risque. Une équipe irlandaise(17) a évalué les résultats du TAVI en cas de bicuspidie, actuellement considérée comme une contre-indication relative. Ces données tirées d’un registre international concernent 142 patients ayant été implantés pour RAC (65 %), maladie aortique (34,7 %) ou insuffisance aortique pure (0,7 %). Tous les types de bicuspidie étaient représentés : type 0 (24 %), type 1 (66 %) ou type 2 (5 %) plus 5 % de non classés. Les 2 prothèses les plus courantes ont été implantées : Edwards SAPIEN (n = 51) et Medtronic CoreValve (n = 91). Le taux de succès global était de 89,5 % avec le lot habituel de complications vasculaires (6 %). Point important : le gradient moyen transprothétique était de 12 ± 10 mmHg et le taux de fuites paraprothétiques de grade ≥ 2/4 était de 28 %, ce qui est plus élevé que les 15 à 20 % habituellement rapportés. La mortalité à J+30 était très proche des taux habituels à 7,7 %. En conclusion, malgré un taux de fuites périprothétiques plus élevé, les résultats du TAVI en cas de bicuspidie semblent acceptables, ce qui mérite d’être vérifié sur de plus amples effectifs et à plus long terme.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :