Valvulopathies
Publié le 31 jan 2014Lecture 11 min
Quand opérer une insuffisance aortique chronique sévère ?
C. TRIBOUILLOY, Service de cardiologie, CHRU Amiens Sud, Amiens
L’insuffisance aortique (IA) représente environ 15 % des valvulopathies sur valve native (figure 1). Les atteintes dystrophiques sont actuellement les plus fréquentes dans les pays industrialisés, les IA rhumatismales devenant rares dans nos régions. Elles sont associées à une dilatation de l’aorte thoracique ascendante dans environ 50 % des cas. Les risques évolutifs sont liés au retentissement ventriculaire gauche (VG) de la régurgitation, source de dysfonction VG, d’insuffisance cardiaque, de décès à long terme, et à l’existence d’une pathologie pariétale aortique, source de dissection et de rupture aortique(1,2). La présence d’une IA sévère et/ou d’une dilatation de l’aorte ascendante associée conduit donc à discuter une éventuelle intervention chirurgicale.
Les plus puissants marqueurs pronostiques identifiés aujourd’hui sont l’âge, la sévérité de l’IA, les symptômes, la dilatation VG, l’altération de la fonction VG et le degré de dilatation aortique. Ces facteurs sont prédictifs de la survie spontanée et/ou postopératoire. Les résultats des séries chirurgicales récentes d’IA opérées sont bons, probablement en rapport avec des interventions plus précoces chez des patients moins symptomatiques atteints d’une cardiopathie moins évoluée. La première étape, basée sur l’échocardiographie, est de vérifier la sévérité de l’insuffisance aortique chronique (tableau 1) et de mesurer les diamètres aortiques (figures 1 et 2), puis de juger de la tolérance fonctionnelle pour distinguer les patients symptomatiques de ceux qui demeurent asymptomatiques. Si l’interrogatoire laisse planer le moindre doute en faveur d’une symptomatologie fonctionnelle chez un patient dit « asymptomatique », on réalise une évaluation à l’effort (épreuve d’effort classique au mieux avec mesure des échanges gazeux respiratoires, écho d’effort) afin de détecter les « faux asymptomatiques ».
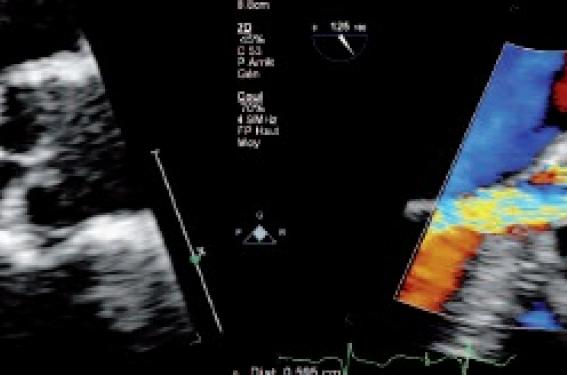
Figure 1. Insuffisance aortique en échocardiographie transthoracique. À gauche, on visualise un défaut de coaptation valvulaire. À droite, insuffisance aortique centrale en Doppler couleur.
Figure 2. Exemple de dilatation anévrysmale de l’aorte ascendante.
IA sévère symptomatique
En présence d’une IA sévère symptomatique, l’indication opératoire en l’absence de contre-indication est à retenir rapidement (tableau 2), car la présence de symptômes – témoignant en général d’une dysfonction VG – est un facteur pronostique péjoratif (figure 2). L’intervention chirurgicale permet une amélioration fonctionnelle et un gain en termes de survie. Si une évaluation à l’effort détecte un « faux asymptomatique », la chirurgie doit aussi être envisagée.
IA chronique asymptomatique
Les indications chirurgicales chez les « vrais asymptomatiques » sont plus discutées. En effet, les données de la littérature montrent qu’une IA chronique volumineuse avec dilatation VG peut demeurer asymptomatique pendant de longues périodes, pouvant excéder 10 ou 15 ans, sans altération définitive de la fonction systolique. On hésite donc entre intervenir trop tôt en raison du risque opératoire et des complications des prothèses valvulaires (si l’on opte pour le remplacement prothétique, les plasties étant réalisées plus rarement) ou opérer trop tard en raison du risque de dysfonction ventriculaire gauche et/ou de complications aortiques pariétales. Ces indications opératoires reposent sur l’analyse de différents critères : l’âge, les pathologies associées, les diamètres et volumes télédiastoliques et télésystoliques, la fraction d’éjection (FE) de repos, les diamètres de l’aorte ascendante (figure 3) et le risque opératoire, qui dépend essentiellement des comorbidités et de l’âge.
Figure 3. Site de mesure des différents diamètres de l’aorte ascendante. Le diamètre de l’anneau aortique est mesuré en systole, les 3 autres diamètres (sinus de Valsalva, jonction sinotubulaire, aorte tubulaire en systole).
• Les patients atteints d’une IA chronique avec dysfonction systolique VG (définie par une fraction d’éjection VG < 50 %) sont le plus souvent symptomatiques, mais certains demeurent asymptomatiques. En l’absence de chirurgie, ces patients deviennent rapidement symptomatiques (incidence de survenue des symptômes estimée à plus 25 % par an dans ce sous-groupe) et sont à risque de dysfonction VG irréversible(1,2). Le taux de mortalité est d’autant plus élevé que la FE est diminuée (5,8 %/an quand la FE < 55 % vs 2 %/an quand la FE ≥ 55 %) (figure 2) et que cette diminution est ancienne. Ainsi, en l’absence de symptômes, une diminution de la FE de repos doit conduire à envisager la chirurgie (tableau 2).
• Les patients atteints d’une IA chronique sévère asymptomatique sans dysfonction VG sont plus fréquents. Ils peuvent rester asymptomatiques pendant de longues périodes, sans dégradation de la fonction systolique. L’apparition des symptômes ou d’une dysfonction VG (FE < 50 %) est un facteur prédictif d’évolution défavorable (figures 4 et 5) qui conduit à envisager la chirurgie. Attendre l’installation d’une symptomatologie sévère (dyspnée classes III-IV NYHA) est risqué : la survie postopératoire à 10 ans des patients classes I-II en préopératoire est de 78 % et de 45 % pour les classes préopératoires III-IV(1,2). L’analyse des séries publiées montre que la fréquence d’apparition de symptômes et/ou d’une dysfonction systolique VG est de moins de 6 % par an(1). Cependant, plus du quart des décès ou des dysfonctions VG ne sont pas précédés de symptômes. Le risque de mort subite est faible et concerne surtout les patients avec une très grande dilatation VG.
Figure 4. Courbes de survie sous traitement médical d’une série d’insuffisances aortiques chroniques selon la classe fonctionnelle de la NYHA à l’inclusion. La survie des patients en classe I est significativement meilleure que celle des patients en classe II ou en classe IIIIV (d’après Dujardin et al. Circulation 1999 ; 99 : 1851-7).
Figure 5. Courbe actuarielle de survie d’une série d’insuffisances aortiques chroniques en fonction du niveau de fraction d’éjection du ventricule gauche (d’après Dujardin et al. Circulation 1999 ; 99 : 1851-7).
Chez ces patients asymptomatiques sans dysfonction VG, l’âge et le diamètre télésystolique (DTS) sont les facteurs prédictifs de décès les plus puissants. D’après les travaux de Bonow et coll.(1), le risque de survenue d’un décès, de symptômes ou d’une dysfonction VG systolique est extrêmement faible pour des DTS VG < 40 mm (0 %/an) ou des DTD VG < 70 mm (2 %/an), alors qu’il est élevé quand ces diamètres excèdent respectivement 50 mm (19 %/an) et 70 mm (10 %/an). Il est logique d’indexer les diamètres à la surface corporelle chez les patients de petite taille non obèses (figure 6). En l’absence de chirurgie, le taux de mortalité annuel dans la série de Dujardin et coll. est significativement plus élevé quand le DTS VG indexé dépasse 25 mm/m2 (7,8 %/an versus 1,6 %/an)(2). L’évaluation de la FE à l’effort ne semble pas apporter d’informations supplémentaires majeures(1,2).
L’étude du strain longitudinal global sera peut-être utile dans l’avenir pour affiner les indications opératoires chez ces patients asymptomatiques.
Figure 6. Courbes actuarielles de survie d’une série d’insuffisances aortiques chroniques sous traitement médical selon la valeur à l’entrée de l’étude du diamètre télésystolique ventriculaire gauche (DTS VG).
IA associée à une dilatation anévrysmale de l’aorte thoracique ascendante
Les patients porteurs d’une IA associée à une dilatation anévrysmale de l’aorte ascendante (IA dystrophique, figure 2), que l’on rencontre dans le syndrome de Marfan, la maladie annuloectasiante et les bicuspidies, sont exposés à un risque de dissection aortique ou de rupture aortique, et donc de décès, quelle que soit la sévérité de l’IA. Ce risque est statistiquement d’autant plus important que le diamètre de l’aorte ascendante est important, mais des dissections peuvent survenir pour des diamètres peu, voire non augmentés sur des aortes histologiquement pathologiques. D’une manière générale, ce risque devient considérable quand la dilatation de l’aorte dépasse 60 mm. Ce marqueur du risque de dissection est donc imparfait. Néanmoins, faute de paramètres plus performants prédictifs du risque de dissection, les indications de chirurgie prophylactique de l’aorte ascendante, quelle que soit la sévérité de l’IA, sont aujourd’hui basées sur des valeurs seuils de diamètre (tableau 3) déterminées par un consensus d’experts(1,2). La vitesse de progression des diamètres aortiques est probablement un facteur pronostique tout aussi important que le diamètre mesuré à un moment donné, et doit donc être pris en compte lors de la surveillance d’un patient. Enfin, il faut tenir compte du morphotype du patient, en particulier chez les femmes de petite surface corporelle. Malheureusement, on ne dispose pas de données robustes dans la littérature pour conseiller des valeurs de diamètres aortiques indexés à la surface corporelle, ce qui explique que les dernières recommandations de l’ESC ne fassent pas référence à ce type de seuils indexés(2).
* Histoire familiale de dissection et/ou diamètre de l’aorte qui augmente de plus de 2 mm/an sur des mesures répétées utilisant la même technique d’imagerie, mesurées au même niveau de l’aorte, et confirmées par une autre technique, insuffisance aortique sévère ou insuffisance mitrale sévère, désir de grossesse.
** Coarctation de l’aorte, HTA, antécédent familial de dissection ou d’augmentation du diamètre aortique de plus de 2 mm/an sur des mesures répétées utilisant la même technique d’imagerie, mesurées au même niveau de l’aorte et confirmées par une autre technique.
Le traitement chirurgical
Le traitement chirurgical de l’IA chronique sans dilatation anévrysmale de l’aorte ascendante consiste le plus souvent en un remplacement valvulaire par prothèse mécanique ou bioprothèse. Les plasties aortiques sont plus rarement effectuées et nécessitent un chirurgien expérimenté dans ce domaine. La mortalité opératoire du remplacement valvulaire aortique est proche de 3 % dans les séries récentes. Chez les patients asymptomatiques, ce risque est plus faible (< 1,5 %) et la survie à 5 ans, comprise entre 83 et 90 %, est excellente.
En présence d’une dilatation anévrysmale de l’aorte ascendante, un remplacement combiné de la valve aortique et de l’aorte ascendante avec réimplantation des coronaires peut être indiqué, quelle que soit la sévérité de l’IA (intervention de Bental). Cette chirurgie « prophylactique » de la dissection a permis une amélioration considérable du pronostic de ces patients. Dans le syndrome de Marfan, l’espérance de vie estimée à 45 ans en 1972 atteindrait aujourd’hui 72 ans. La mortalité opératoire dans les séries récentes est faible (< 2 %) et la survie à distance excellente, alors que la mortalité opératoire est très lourde, multipliée par 8 ou 10, au stade aigu d’une complication pariétale aortique.
En présence d’une dilatation anévrysmale de l’aorte avec IA modérée et des valves aortiques paraissant normales en échographie, on peut proposer un remplacement de l’aorte ascendante avec réimplantation des coronaires et conservation de la valve aortique native. Ces interventions (Tirone David et Yacoub) sont très intéressantes, car elles évitent la mise en place et les complications d’une prothèse valvulaire et, entre des mains expertes, donnent de bons résultats à long terme.
Indications opératoires : les recommandations de l’ESC 2012(2)
IA sévère sans dilatation anévrysmale de l’aorte ascendante associée
Les indications opératoires dans l’IA sévère sans dilatation anévrysmale de l’aorte ascendante associée n’ont pas été modifiées par rapport à la précédente mouture de 2007 (tableau 2). La chirurgie est clairement recommandée pour les patients symptomatiques, et chez les asymptomatiques avec fraction d’éjection (FE) de repos < 50 %. Elle est aussi recommandée si une chirurgie de pontage, de l’aorte ascendante ou sur une autre valve, est indiquée. Elle est conseillée (recommandation de classe IIa) chez les patients asymptomatiques dont la FE est > 50 % et qui ont un diamètre télédiastolique ventriculaire gauche (DTD VG) > 70 mm ou un diamètre télésystolique (DTS) > 50 mm (> 25 mm/m2 chez les patients de petite surface corporelle). Un remplacement de l’aorte ascendante associé est proposé si les diamètres aortiques sont > 45 mm.
IA associée à une dilatation anévrysmale de l’aorte ascendante
On note des évolutions importantes basées sur les résultats d’études observationnelles récentes dans les indications de chirurgie en présence d’une dilatation de l’aorte ascendante (quelle que soit la sévérité de l’IA) qui vont, dans certains cas, pour le syndrome de Marfan et la bicuspidie, dans le sens d’un recours moins précoce à la chirurgie prophylactique (tableau 3).
Dans tous le cas, sauf contre-indication, la chirurgie préventive de l’aorte ascendante est recommandée quand le diamètre de l’aorte ascendante excède 55 mm, quel que soit le site de mesure.
Dans le syndrome de Marfan, la chirurgie prophylactique de l’aorte est recommandée quand le diamètre maximal de l’aorte ascendante est ≥ 50 mm (classe IC) ou > 45 mm (classe IIA) s’il existe des facteurs de risque vasculaire (FRV). Ces FRV correspondent :
- à une histoire familiale de dissection et/ou à un diamètre de l’aorte qui augmente de plus de 2 mm/an sur des mesures répétées utilisant la même technique d’imagerie, effectuées au même niveau de l’aorte, et confirmées par d’autres techniques ;
- à une insuffisance aortique sévère ou à une insuffisance mitrale sévère ;
- ou, enfin, à un désir de grossesse.
Pour les bicuspidies, on note aussi un certain recul pour le seuil de diamètres pour les indications chirurgicales. Le remplacement de l’aorte ascendante est conseillé (recommandation classe IIa C) quand le diamètre dépasse 55 mm, ou 50 mm en présence de FRV. Ces FRV sont les suivants :
- antécédent personnel de coarctation de l’aorte ;
- existence d’une HTA ;
- antécédent familial de dissection ;
- augmentation du diamètre aortique de plus de 2 mm/an documenté dans les mêmes conditions que pour le syndrome de Marfan.
Traitement médical
En pratique, aujourd’hui, l’utilisation des vasodilatateurs (IEC, ARA2 ou dihydropyridine) n’est pas recommandée pour différer les indications chirurgicales admises. En effet, leur intérêt pour retarder la chirurgie chez les patients asymptomatiques ayant une IA sévère ou modérée sans indication chirurgicale n’est pas prouvé. Une étude randomisée en 3 groupe s incluant 90 patients asymptomatiques (figure 7) atteints d’une IA sévère sans dysfonction VG initiale a montré que la nifédipine et l’énalapril, par comparaison avec l’absence de traitement, ne permettaient pas de retarder la chirurgie ni de réduire le volume régurgité de l’IA, la taille du VG ou d’améliorer la fonction du VG. Ces médicaments trouvent leur place chez les patients symptomatiques et/ou avec dysfonction du VG qui ne peuvent être opérés en raison de comorbidités majeures, en présence d’une HTA associée, et après remplacement valvulaire aortique quand une dysfonction du VG persiste.
Figure 7. Étude randomisée en 3 groupes, incluant 90 patients atteints d’une insuffisance aortique chronique asymptomatique sévère sans dysfonction ventriculaire gauche, montrant que la nifédipine et l’énalapril par comparaison avec l’absence de traitement ne permettent pas de retarder la chirurgie valvulaire (d’après Evangelista et al. New Engl J Med 2005 ; 353 : 1342).
Les bêtabloquants sont systématiquement Recommandés pour prévenir la dissection aortique dans le syndrome de Marfan quand l’IA n’est pas sévère : ils ralentissent la progression de la dilatation de la racine aortique et réduisent le risque de survenue d’événements cardiovasculaires (dissection, chirurgie, etc.). Ils sont également recommandés dans le syndrome de Marfan après la chirurgie pour prévenir les récidives de dissection.
Modalités de surveillance en l’absence d’indication d’intervention
En l’absence de symptomatologie fonctionnelle, les patients avec IA modérée doivent être suivis cliniquement et par échocardiographie tous les 2 ou 3 ans. En présence d’une IA volumineuse ou d’une dilatation de l’aorte ascendante associée, le suivi est impératif : tous les 6 mois (si l’on approche des valeurs seuils) ou tous les ans, selon le degré et l’évolutivité du retentissement sur le VG, et selon le diamètre de l’aorte ascendante. Le scanner et surtout l’IRM sont les meilleurs examens pour surveiller l’évolution de la dilatation de l’aorte ascendante quand l’échocardiographie ne permet pas des mesures des diamètres aortiques fiables et reproductibles.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :