Congrès et symposiums
Publié le 14 déc 2013Lecture 6 min
Implantation percutanée de bioprothèses aortiques : résultats, limites
C. TRON, M. GODIN, E. DURAND, N. BOUHZAM, H. ELTCHANINOFF, hôpital Charles-Nicolle, CHU de Rouen
CNCF
Depuis la réalisation à Rouen en avril 2002 par notre équipe de la première implantation de valve aortique par voie percutanée (TAVI pour Transcatheter Aortic Valve Implantation), cette technique n’a fait que progresser, permettant d’être actuellement une solution thérapeutique validée pour les patients symptomatiques présentant un rétrécissement aortique serré et ayant soit une contre-indication à la chirurgie conventionnelle, soit un haut risque chirurgical évalué par une équipe médico-chirurgicale(1). De nombreuses études et registres(2-6) ont été consacrés à cette technique, permettant d’en bien connaître les résultats et les limites actuels.
Résultats
(tableau)
Succès d’implantation
L’implantation d’une valve par cathéter est maintenant une technique bien maîtrisée avec des taux de succès qui n’ont cessé de croître depuis quelques années du fait des améliorations technologiques et de l’expérience croissante des opérateurs. Il est actuellement possible d’implanter la valve dans plus de 95 % des cas, comme le démontrent tous les grands registres internationaux. Les complications immédiates telles que les ruptures d’anneau, les migrations de valve ou les occlusions coronaires sont exceptionnelles, inférieures à 1 %. La qualité des résultats hémodynamiques (obtention d’une surface aortique à environ 1,7 cm2) entraîne le plus souvent une amélioration fonctionnelle quasi-immédiate.
Complications vasculaires
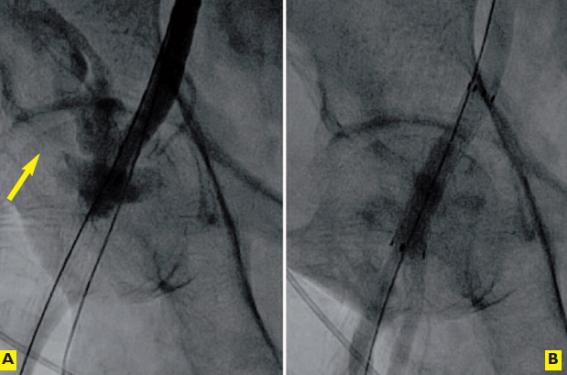
Les complications vasculaires sont les plus fréquentes, avec une fréquence variable selon la définition utilisée, et elles sont une cause importante de morbidité et mortalité. Le taux de complications vasculaires est de 30,7 % dans l’étude PARTNER (taux de complications majeures de 16,2 %) où l’on utilisait des introducteurs de gros calibre 22 à 24 F. Avec les introducteurs actuellement utilisés en Europe (16 à 20 F), les complications vasculaires majeures sont sensiblement similaires avec la CoreValve (8,3 % lors de l’étude américaine récemment présentée au dernier congrès TCT) et avec la valve Edwards (7,3 % dans le registre SOURCE XT). Cependant, on peut raisonnablement espérer une diminution prochaine des complications vasculaires, non pas tant du fait d’une meilleure sélection des patients, mais surtout, du fait de l’expérience croissante des équipes et des progrès technologiques. À ce titre, il est remarquable de noter qu’il n’y a eu aucune complication vasculaire dans la récente expérience de l’équipe de Vancouver avec la nouvelle valve SAPIEN 3, implantable à travers un introducteur de plus petit calibre (seulement 14 F), même s’il ne s’agit que d’une série très limitée de 15 patients(7). De plus, il est maintenant de plus en plus souvent possible de traiter ces complications vasculaires par voie percutanée (figure).
Figure. A. Échec de fermeture du point de ponction artériel responsable d’une extravasation du produit de contraste (flèche). B. Réparation artérielle après implantation par voie controlatérale d’un stent couvert.
Insuffisance aortique
Une insuffisance aortique, quasiment constamment paravalvulaire, est observée dans près de 2/3 des cas après un TAVI, du fait d’une apposition incomplète de la prothèse au niveau de l’anneau aortique. Cependant, chez la plupart des patients, cette fuite paraprothétique est minime, sans conséquence hémodynamique, et bien tolérée. En revanche, il est actuellement admis que cette insuffisance aortique a un impact pronostique important avec une augmentation de la mortalité au cours du suivi en cas de fuite ≥ grade 2. Plusieurs mécanismes peuvent contribuer à l’existence d’une insuffisance aortique paravalvulaire tels qu’un sous-dimensionnement de la prothèse, une implantation trop haute ou trop basse de la prothèse, la présence de calcifications aortiques massives. Du fait de leur impact pronostique, il est fondamental d’essayer de réduire au maximum ce risque de fuite paravalvulaire. Il est maintenant démontré que le scanner cardiaque, par l’analyse tridimensionnelle de l’anneau aortique qu’il autorise, permet de mieux adapter la taille de la prothèse à celle de l’anneau aortique que les mesures échographiques, ce qui pourrait réduire les fuites paraprothétiques. Des améliorations technologiques devraient également permettre de diminuer l’importance des fuites aortiques péri-valvulaires, la nouvelle valve SAPIEN 3, actuellement en cours d’évaluation, disposant par exemple d’une couronne externe pour combler les interstices entre la prothèse et l’anneau aortique(7).
Accidents vasculaires cérébraux
Les accidents vasculaires cérébraux sont relativement rares (de 2 à 5 % selon les séries), mais sont une complication particulièrement redoutée. Ce risque est inhérent au franchissement de la valve aortique calcifiée, à la valvuloplastie aortique, au déploiement de la valve et à la manipulation de cathéters de gros calibres au niveau de l’aorte ascendante et de la crosse aortique chez des patients souvent à très haut risque vasculaire. De plus, la prévalence de la fibrillation auriculaire est importante dans cette population, expliquant probablement en partie certains accidents vasculaires cérébraux survenant en post-intervention. Même si la plupart des équipes s’accordent actuellement sur l’utilisation d’une bi-antiagrégation plaquettaire en post-intervention, le traitement antithrombotique de référence, tant pour encadrer l’intervention qu’à long terme, reste à déterminer. Des systèmes de protection cérébrale sont actuellement en développement et les études en cours devraient nous indiquer si ces systèmes ont une place pour réduire l’incidence des accidents vasculaires cérébraux.
Troubles de conduction
La proximité des voies de conduction avec la valve aortique explique la fréquence des troubles de conduction observée après un TAVI. Le risque de survenue d’un bloc auriculoventriculaire en post-intervention est la principale différence entre les 2 valves actuellement commercialisées avec un taux d’implantations de pacemaker d’environ 25 % après CoreValve contre environ 5 % après une valve Edwards(6).
Mortalité
La mortalité à 30 jours peut être estimée entre 5 et 10 %, dépendant d’une part de l’expérience des équipes, mais surtout des comorbidités des patients traités. Il est à noter que la mortalité des interventions par voie transfémorale est inférieure à celle des interventions réalisées par voie transapicale ou sous-clavière, sans que l’on puisse savoir si cette différence de mortalité est en rapport direct avec le type d’implantation ou avec des comorbidités plus sévères, et donc un risque opératoire plus important dans les populations traitées par voie non fémorale. Cependant, ces résultats justifient l’utilisation préférentielle de la voie transfémorale chaque fois que celle-ci est possible. La mortalité à un an reste élevée dans toutes les séries, de 20 à 30 %, dépendant en partie de l’importance des comorbidités.
Suivi
L’amélioration fonctionnelle notée au décours de l’implantation persiste au cours du suivi, entraînant une nette amélioration de la qualité de vie des patients. L’équipe de Vancouver a récemment rapporté des résultats très satisfaisants au cours d’un suivi de 5 ans après implantation(8). En effet, plus de 90 % des patients sont en classe I ou II de la NYHA, les résultats hémodynamiques se maintiennent, et seulement 3 dégénérescences modérées de prothèses (3,4 % de leur population) sont observées, sans nécessité de réintervention.
Limites
Les limites actuelles de la technique sont en rapport avec les complications précédemment décrites et avec le manque de recul concernant la durabilité de la valve. Une des principales difficultés avec cette nouvelle technique est de savoir y renoncer lorsque l’importance des comorbidités rend illusoire une amélioration fonctionnelle satisfaisante ou une survie durable (insuffisance respiratoire sévère, maladies neuro-dégénératives, etc.). La technique n’a pour l’instant été évaluée que dans des populations à haut risque chirurgical et, même si l’on peut espérer une diminution des complications chez des patients moins fragiles, il est indispensable d’attendre les résultats des études en cours (PARTNER 2, SURTAVI) sur des populations à risque moins élevé avant de proposer une implantation percutanée à des patients sans haut risque chirurgical. Enfin, le manque de données concernant le devenir de la valve implantée au-delà de 5 ans est un autre argument pour limiter actuellement les implantations aux patients ayant une contre-indication à la chirurgie ou un haut risque chirurgical.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :